2021-2022學年吉林省松原市長嶺三中高二(上)第一次月考化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括20個小題,每小題只有1個選項符合題意,1-10每小題2分,11-20每小題2分,共50分)
-
1.鹽類水解在生活中具有廣泛的應用,下列事實跟水解原理無關的是( )
A.施加適量的石膏可以改良鹽堿地 B.用硫酸鋁和小蘇打生產泡沫滅火器 C.用TiCl4制備TiO2?xH2O時,加入大量水 D.保存FeSO4溶液時,加入少量鐵粉 組卷:9引用:1難度:0.6 -
2.某學生的實驗報告所列出的下列數據中合理的是( )
A.用25mL滴定管做中和滴定實驗時,用去某濃度的堿溶液21.70mL B.用托盤天平稱得25.20g NaCl C.用廣泛pH試紙測得某溶液的pH為2.3 D.用10mL量筒量取7.13mL稀鹽酸 組卷:5引用:2難度:0.9 -
3.下列各式中屬于正確的水解反應離子方程式的是( )
A. +H2O?NH3?H2O+H+NH+4B.S2-+2H2O?H2S+2OH- C.CH3COOH+H2O?CH3COO-+H3O+ D.CH3COOH+OH-?CH3COO-+H2O 組卷:27引用:14難度:0.9 -
4.反應 4A(g)+5B(g)=4C(g)+6D(g),在不同情況下測得的反應速率如下,其中反應速率最大的是( )
A.v(D)=0.4mol?L-1?s-1 B.v(C)=0.5mol?L-1?s-1 C.v(B)=0.6mol?L-1?s-1 D.v(A)=0.15mol?L-1?s-1 組卷:43引用:3難度:0.6 -
5.對于反應2SO2(g)+O2(g)?2SO3(g)△H<0已達平衡,如果其他條件不變時,分別改變下列條件,對化學反應速率和化學平衡產生影響,下列條件與圖象不相符的是( )(t1時刻v正=v逆;t1時改變條件,t2時重新建立平衡)
A. 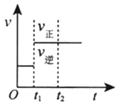
加入催化劑B. 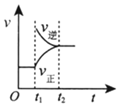
增加SO3濃度C. 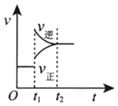
升高溫度D. 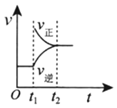
增大壓強組卷:25引用:2難度:0.6 -
6.T℃時,反應A(g)+B(g)?2C(g)的化學平衡常數K為100,則T℃時,反應C(g)?
A(g)+12B(g) 的化學平衡常數K為( )12A.100 B.0.01 C.0.1 D.1 組卷:18引用:3難度:0.7 -
7.25℃時,水的電離達到平衡:H2O?H++OH-ΔH>0,下列敘述正確的是( )
A.向水中加入氨水,平衡逆向移動,c(OH-)降低 B.向水中加入少量固體硫酸氫鈉,c(H+)增大,KW不變 C.向水中加入少量固體CH3COONa,平衡逆向移動,c(H+)降低 D.將水加熱,KW增大,pH不變 組卷:1185引用:173難度:0.9
二、填空題(共50分)
-
21.由化學能產生的能量是目前人類使用的主要能源。請回答下列問題:
(1)如圖1所示:反應2H2+O22H2O的能量變化。點燃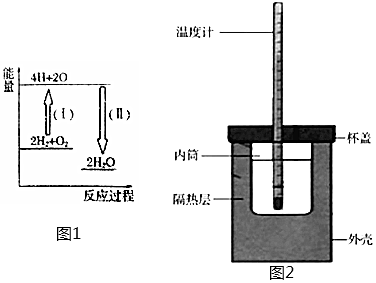
①已知拆開1molH—H、1molO=O和1molH—O中的化學鍵分別需要消耗436kJ、496kJ和463kJ的能量。則反應過程(Ⅱ)(填“吸收”或“放出”)kJ。
②已知:Ⅰ.CO(g)+2H2(g)═CH3OH(l)△H=-128.6kJ/mol
Ⅱ.2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
Ⅲ.2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
寫出CH3OH燃燒熱的熱化學方程式:。
(2)用如圖2所示的裝置進行中和熱的測定實驗,分別取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸進行實驗,回答下列問題:
①從圖實驗裝置看,其中尚缺少的一種玻璃用品是。
②若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液進行反應,與上述實驗相比,所放出的熱量(填“相等”或“不相等”)。所求得的中和熱(填“相等”或“不相等”)。組卷:4引用:1難度:0.6 -
22.實驗室有瓶混有泥沙的乙二酸樣品,小明測定樣品中乙二酸的含量,操作為:配制250mL溶液:準確稱量5.0g乙二酸樣品,配成250mL溶液。
(1)滴定:準確量取25.00mL所配溶液于錐形瓶中,加少量酸酸化,將0.1000mol?L-1KMnO4溶液裝入(填“酸式”或“堿式”)滴定管,進行滴定操作,當時,證明達到滴定終點。
(2)滴定過程中發生反應的離子方程式為。
(3)計算:再重復上述操作2次,記錄實驗數據如下:
已知H2C2O4的相對分子質量為90,則此樣品的純度為序號 滴定前讀數(mL) 滴定后讀數(mL) 1 0.00 20.10 2 1.00 20.90 3 0.00 22.10 。
(4)誤差分析:下列操作會導致測定結果偏高的是。
A.滴定管在盛裝KMnO4溶液前未潤洗
B.滴定過程中,錐形瓶振蕩得太劇烈,以致部分液體濺出
C.滴定前讀數正確,滴定終點時俯視讀數
D.裝待測液的錐形瓶用蒸餾水洗滌后,沒用待測液潤洗
(5)有一支50mL滴定管中盛裝某溶液,液面恰好在amL刻度處,把管內液體全部放出,盛入量筒內,所得液體體積一定是。
A.amL
B.(50-a)mL
C.大于(50-a)mL
D.大于amL組卷:4引用:1難度:0.9


