2020-2021學年安徽省合肥四十八中望湖校區九年級(上)段考化學試卷(10月份)
發布:2024/4/20 14:35:0
一、本大題包括12小題,每小題1分,共12分。每小題的4個選項中只有1個符合題意。
-
1.下列變化中,屬于化學變化的是( )
A.電燈發光 B.酒精揮發 C.節日煙火 D.輪胎爆炸 組卷:7引用:1難度:0.3 -
2.古往今來,無數的科學家為科學的發展做出了巨大貢獻,下列說法錯誤的是( )
A.屠呦呦發現抗瘧疾新藥青蒿素 B.張青蓮主持測定了幾種元素相對原子質量的新值 C.門捷列夫發現了元素周期律并編制出元素周期表 D.拉瓦錫創立的原子論和分子學說奠定了近代化學的基礎 組卷:16引用:2難度:0.7 -
3.化學是一門以實驗為基礎的的科學,在實驗操作中我們會經常使用膠頭滴管,下列實驗操作正確的是( )
A. 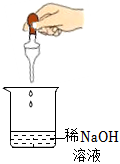
滴加酚酞B. 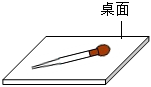
放置滴管C. 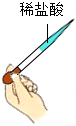
取用鹽酸D. 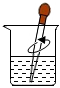
攪拌溶液組卷:9引用:1難度:0.9 -
4.下列物質中屬于純凈物的是( )
A.汽水 B.潔凈的空氣 C.水泥砂漿 D.液態氧 組卷:928引用:141難度:0.9 -
5.下列有關實驗現象的描述正確的是( )
A.硫在空氣中燃燒產生明亮的藍紫色火焰,放熱,生成有刺激性氣味的氣體 B.汞在空氣中持續加熱會生成紅色粉末 C.氫氧化鈉溶液中滴加硫酸銅溶液出現藍色絮狀沉淀氫氧化銅 D.將火柴梗平放入蠟燭的火焰中,約1秒后取出,火柴梗與內焰接觸部分最先變黑 組卷:4引用:1難度:0.6
二、非選擇題(本大題包括5小題,每空1分,共28分。)
-
16.某化學興趣小組設計如表所示的對比實驗來比較二氧化錳和氧化銅對過氧化氫分解的催化效果,所用實驗裝置如圖所示。
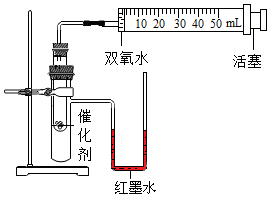
(1)實驗1中制取氧氣的文字表達式為實驗序號 過氧化氫溶液 催化劑 實驗1 5mL4% 粉末狀MnO20.2g 實驗2 5mL4% 粉末狀CuO0.2g 。
(2)實驗需要測量并記錄的數據有:氧氣體積和。
(3)實驗時,分別將過氧化氫溶液一次性注入盛有催化劑的小試管中,測量并記錄數據,實驗過程中發現U型管內右側液面上升,原因是。
(4)結論:MnO2對過氧化氫分解的催化效果比CuO好,得出該結論的依據是。
(5)化學興趣小組的同學們又分別設計如圖四組實驗,來比較二氧化錳和氧化銅對過氧化氫溶液分解的催化效果,其中觀察效果最差的。
A.第一組同時實驗,觀察比較反應過程中兩個氣球體積的變化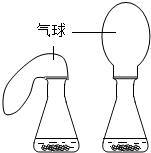
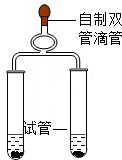

第一組 第二組 第三組 第四組
B.第二組同時實驗,觀察比較反應過程中兩個試管內產生氣泡的快慢
C.第三組分兩次實驗,看木條是否能復燃
D.第四組分兩次實驗,比較收集一定體積的氣體所需要的時間組卷:13引用:1難度:0.8 -
17.空氣中氧氣含量測定的經典賞析。
教材中介紹了拉瓦錫用定量的方法研究了空氣的成分(實驗裝置如圖)。
(1)寫出汞與氧氣反應的文字表達式。
(2)有關該實驗的說法中,正確的是(填序號)。
A.汞在加熱的條件下,只和氧氣反應。
B.汞為液態,在汞槽中起到液封的作用,但不能直接用來測量反應器內空間體積的變化。
C.氧化汞的密度小于汞的密度,且不溶于汞,易與汞分離。
D.銀白色的汞劇烈燃燒,迅速生成紅色粉末。
E.汞的沸點較低,汞蒸氣與氧氣反應比較充分,能將密閉裝置內的氧氣幾乎耗盡。
(3)通過實驗,拉瓦錫得出了空氣由氧氣和氮氣組成,其中氧氣約占空氣總體積的結論。請根據現在的認識,對此結論予以補充。(提示:從成分、含量角度回答)15。
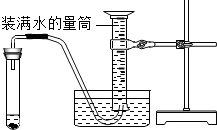
(4)化學興趣小組的同學進行了實驗探究。他們設計的實驗方案是先將氧氣和空氣按不同的體積比收集在集氣瓶里。收集氣體的裝置如圖,方法是:在100mL集氣瓶里裝滿水,塞緊橡膠塞并關閉活塞b,打開活塞a通入氧氣,把瓶里的水排入量筒,當量筒內的水達到設定的體積后立即關閉活塞a,然后打開活塞b通入空氣,把瓶里的水全部排入量筒。若要收集一瓶含氧氣的體積分數約為60%的氣體,則通入氧氣的體積和通入空氣的體積約是。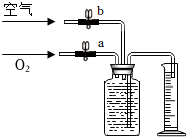
A.50mL和50mL
B.60mL和40mL
C.40mL和60mL
D.20mL和80mL
(5)化學興趣小組的同學在老師的指導下對“測定空氣中氧氣含量”的實驗進行了改進:將數顯設備、氣體壓強傳感器和空氣中氧氣含量測量裝置按如圖連接。裝置氣密性良好,調節右邊敞口容器和集氣瓶里的水面相平,此時集氣瓶內氣體的體積為V1。關閉活塞,點燃燃燒匙內的紅磷,立即塞緊瓶塞,待火焰熄滅后,過一段時間打開活塞,觀察到集氣瓶中的水位上升。待集氣瓶內的水面不再上升時,集氣瓶內的氣體體積為V2;然后向右邊容器內加入一定量的水至兩邊水面再次相平,此時集氣瓶內的氣體體積為V3。在點燃紅磷至打開活塞這一過程中,觀察到數顯設備顯示集氣瓶內的氣體壓強先上升后下降,再趨于穩定。
請回答: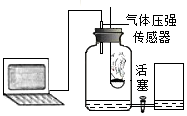
①數顯設備顯示,開始一段時間集氣瓶內氣體壓強上升,這是因為溫度升高導致的氣壓變化量(選填“大于”、“等于”或“小于”)氧氣量減少導致的氣壓變化量。
②基于數顯設備顯示的氣壓變化,“過一段時間打開活塞”中的“一段時間”指的是火焰熄滅后到所經歷的時間。
③在整個實驗過程中,集氣瓶中減少的氧氣體積為(選填“V1-V2”、“V1-V3”或“V2-V3”)。組卷:60引用:1難度:0.5


