2020-2021學年福建省莆田二中高三(上)質檢化學試卷(9月份)
發布:2024/12/31 14:30:3
一、單選題(每小題2分,共32分。每題只有一個正確選項)
-
1.碰撞理論和過渡態理論都是化學反應速率這一模塊中比較重要的理論,下列說法正確的是( )
A.增大反應物濃度,單位體積內的活化分子數增加,反應速率減小 B.升高溫度,單位體積內活化分子數增加,反應速率加快 C.增大壓強,有效碰撞次數一定增加,反應速率加快 D.使用催化劑,正逆兩方向的活化能同等程度增加,反應速率加快 組卷:13引用:2難度:0.7 -
2.能源的開發與利用是21世紀科技界的熱點,下列關于能源的說法正確的是( )
A.化石燃料是不可再生能源,大量使用化石燃料會造成溫室效應和酸雨 B.使用石油氣的爐灶改燒天然氣,應加大空氣進氣量 C.把煤做成蜂窩煤,能夠減少二氧化硫排放,從而減少酸雨的產生 D.氮氧化物的大量排放是造成光化學煙霧的原因之一,乙醇汽油的使用可避免產生氮氧化物 組卷:4引用:1難度:0.8 -
3.聯氨(N2H4)常溫下為無色液體,可用作火箭燃料。下列說法不正確的是( )
①2O2(g)+N2(g)=N2O4(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048.9kJ?mol-1A.O2(g)+2H2(g)=2H2O(l)△H5,△H5>△H3 B.△H4=2△H3-2△H2-△H1 C.1molO2(g) 和2molH2(g)具有的總能量高于2molH2O(g) D.聯氨和N2O4作火箭推進劑的原因之一是反應放出大量的熱 組卷:115引用:10難度:0.7 -
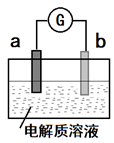 4.30℃時,利用如圖裝置進行實驗,結果記錄如表所示:
4.30℃時,利用如圖裝置進行實驗,結果記錄如表所示:
下列說法不正確的是( )實
驗a
電極b
電極電解質
溶液現象 I Cu Zn 稀H2SO4 檢流計指針向左偏轉 Ⅱ Fe Al 稀H2SO4 檢流計指針向左偏轉 Ⅲ Fe Al 濃H2SO4 檢流計指針先向左偏轉,后逐漸歸零,a電極表面逐漸變黑,b電極表面逐漸變白 Ⅳ Fe Al 濃HNO3 檢流計指針迅速向右偏轉,a電極逐漸溶解,b電極表面逐漸變白 A.Ⅱ中Al為負極,其電極反應是:Al-3e-═Al3+ B.Ⅲ中的現象說明Fe和Al表面形成致密的氧化膜,阻止了電極反應的進行 C.Ⅳ中Fe為負極,發生了氧化反應 D.上述實驗表明:相同條件下,Fe在濃HNO3中更穩定,Al在濃H2SO4中更穩定 組卷:8引用:1難度:0.6 -
5.一定條件下,碳鋼腐蝕與溶液pH的關系如下:
下列說法不正確的是( )pH 2 4 6 6.5 8 13.5 14 腐蝕快慢 較快 慢 較快 主要產物 Fe2+ Fe3O4 Fe2O3 FeO-2A.在pH<4溶液中,碳鋼主要發生析氫腐蝕 B.在pH>6溶液中,碳鋼主要發生吸氧腐蝕 C.在pH>14溶液中,碳鋼腐蝕的正極反應為O2+4H++4e-═2H2O D.在煮沸除氧氣后的堿性溶液中,碳鋼腐蝕速率會減緩 組卷:338引用:20難度:0.7 -
6.二氧化碳在溶液中的存在形式隨溶液pH的變化如下圖所示,下列說法正確的是( )
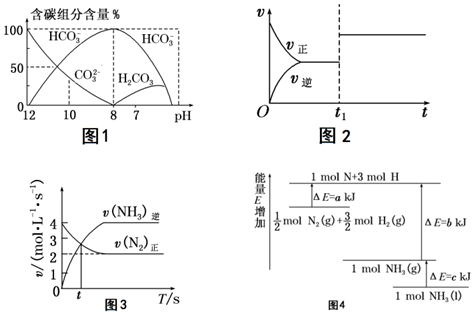
A.由圖1可知碳酸的第二步電離平衡常數的數量級為10-10 B.圖2表示的是H2(g)+I2(g)?2HI(g)在t1時刻達到平衡后使用催化劑的速率變化圖像 C.圖3中t時刻代表合成氨反應達到了化學平衡狀態 D.由圖4可知,N2(g)+3H2(g)?2NH3(g)ΔH=-2(b+c-a)kJ/mol 組卷:14引用:1難度:0.7 -
7.下列關于化學平衡狀態的說法正確的有( )
①密閉容器內發生H2(g)+I2(g)?2HI(g),達到平衡后縮小容器的體積,容器內顏色變深,說明平衡往正向移動
②裝有NO2的密閉容器,2NO2?N2O4,顏色不再變化則達到了平衡狀態
③N2(g)+3H2(g)?2NH3(g),斷掉N-H的個數與形成H-H的個數比為2:1,說明反應達到了平衡狀態
④2SO2(g)+O2(g)?2SO3(g),恒壓條件下密度不再改變時達到了平衡狀態
⑤N2(g)+3H2(g)?2NH3(g),當2v(NH3)=3v(H2)時達到了平衡狀態
⑥C(s)+H2O(g)?CO(g)+H2(g),當氣體的平均相對分子質量不再改變時達到了平衡狀態A.2個 B.3個 C.4個 D.5個 組卷:3引用:1難度:0.6 -
8.某科研小組研究采用BMED膜堆(如示意圖),模擬精制濃海水為原料直接制備酸堿。BMED膜堆包括陽離子交換膜、陰離子交換膜和雙極膜(A、D)。已知:在直流電源的作用下,雙極膜內中間界面層發生水的解離,生成H+和OH-.下列說法錯誤的是( )

A.電極a連接電源的正極 B.B為陽離子交換膜 C.電解質溶液采用Na2SO4溶液;避免有害氣體的產生 D.Ⅱ口排出的是淡水 組卷:53引用:7難度:0.7
三、非選擇題(共48分)
-
24.1-丁烯是一種重要的化工原料,可由正丁烷催化脫氫制備。
(1)正丁烷脫氫制1-丁烯的熱化學方程式如下:C4H10(g)═C4H8(g)+H2(g)ΔH
已知三種物質的燃燒熱:
則該反應的△H為化學式 C4H10 C4H8 H2 ΔH(kJ?mol-1) -2878.0 -2719.1 -285.8 kJ?mol-1。
正丁烷平衡轉化率與反應溫度及壓強的關系如圖1所示。M點的正反應速率(填“大于”“小于”或“等于”)N點的逆反應速率。若起始通入正丁烷的物質的量為2mol,則Q點的平衡常數Kp=MPa(計算結果保留2位有效數字)。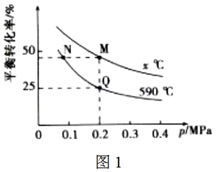
(2)利用CO2的弱氧化性,開發了正丁烷氧化脫氫制1-丁烯的新工藝,其反應機理如圖2。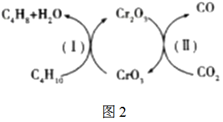
①根據上圖可知,該反應的催化劑為(填化學式)。
②該工藝可以有效消除催化劑表面的積炭,維持催化劑活性,原因是(用化學方程式表示)。
(3)某研究小組向密閉容器中充入一定量的1-丁烯和氫氣,分別在甲、乙兩種不同催化劑作用下發生反應,相同時間后測得正丁烷的產率與溫度的關系如圖3。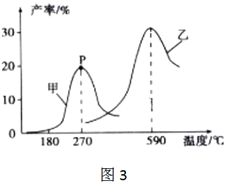
①在催化劑甲作用下,溫度低于180℃時,正丁烷的產率隨溫度升高變化不大,主要原因是。
②P點是否為對應溫度下正丁烷的平衡產率?理由是。組卷:7引用:1難度:0.4 -
25.研究和深度開發CO、CO2的應用對構建生態文明社會具有重要的意義。
(1)CO可用于煉鐵,已知:Fe2O3(s)+3C(s)=2Fe (s)+3CO(g) ΔH 1=+489.0kJ?mol-1,
C(s)+CO2(g)=2CO(g) ΔH 2=+172.5kJ?mol-1, 則CO還原Fe2O3(s)的熱化學方程式為。
(2)CO與O2設計成原電池(以熔融K2CO3溶液為電解液)。該電池的正極反應式為。
(3)CO2和H2充入一定體積的恒容密閉容器中,在兩種溫度下發生反應:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g) ΔH=-Q kJ/mol(Q>0)
①一定溫度下,在容積相同且固定的兩個密閉容器中,按如下方式加入反應物,一段時間后達到平衡。
若甲中平衡后氣體的壓強為開始的0.8倍,要使平衡后乙與甲中相同組分的體積分數相等,且起始時維持化學反應向逆反應方向進行,則b的取值范圍為容 器 甲 乙 反應物投入量 1mol CO2、3mol H2 a mol CO2、3a mol H2、
b mol CH3OH(g)、b mol H2O(g)。
②現有兩個體積相同的剛性容器丙和丁,丙維持恒溫,丁為絕熱容器。往丙中充入1mol CO2和3mol H2,往丁中充入1mol CH3OH(g)和1 mol H2O (g)。分別達到平衡狀態,下列說法正確的是。
A.兩個容器的熱效應之和|Q丙|+|Q丁|=Q
B.丙中CO2的轉化率與丁中CH3OH(g)的轉化率之和小于1
C.丙中CH3OH(g)的體積分數大于丁
D.達到平衡所需的時間:丙小于丁
(4)利用光能和光催化劑,可將CO2和H2O(g)轉化為CH4和O2。紫外光照射時,在不同催化劑(I、II、III)作用下,CH4產量隨光照時間的變化如圖1。在0~15小時內,CH4的平均生成速率I、II和III從小到大的順序為(填序號)。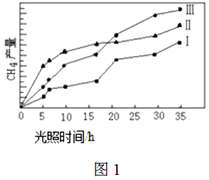
(5)以TiO2/Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化成乙酸。在不同溫度下催化劑的催化效率與乙酸的生成速率的關系如圖2。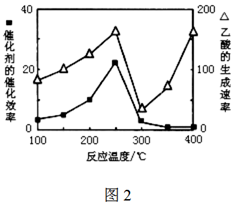
①當溫度在范圍時,溫度是乙酸生成速率的主要影響因素。
②Cu2Al2O4可溶于稀硝酸,稀硝酸還原產物為NO,寫出有關的離子方程式。組卷:6引用:1難度:0.3


