2021-2022學年河南省鄭州市育人高級中學高二(上)月考化學試卷(11月份)
發布:2024/4/20 14:35:0
一、選擇題(本大題共16小題,每小題3分,共48分。每個小題列出的四個備選項中只有一個是符合題目要求的,不選、多選、錯選均不給分)
-
1.下列有關說法中正確的是( )
A.將煤液化為CH3OH使用,有利于碳達峰、碳中和 B.平衡常數越大的可逆反應,速率越快 C.不水解的鹽溶液一定顯中性 D.Ksp小的難溶電解質可能會轉化為Ksp大的難溶電解質 組卷:1引用:1難度:0.8 -
2.下列化學反應一定屬于放熱反應的是( )
A.反應物的總鍵能為:150kJ/mol,生成物的總鍵能為:260kJ/mol B.常溫下不加熱即可發生的化學反應 C.反應物的總能量為:780kJ/mol,生成物的總能量為:890kJ/mol D.正反應的活化能為:360kJ/mol,逆反應的活化能為:285kJ/mol 組卷:2引用:1難度:0.8 -
3.已知:二苯醚既可發生水解反應:
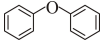 (g)+H2O(g)→2
(g)+H2O(g)→2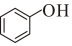 (l)ΔH1=-7.1kJ/mol;也可發生氫解反應:
(l)ΔH1=-7.1kJ/mol;也可發生氫解反應: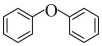 (g)+H2(g)→
(g)+H2(g)→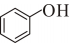 (l)+
(l)+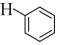 (g)△H2=-14.2kJ/mol;則反應
(g)△H2=-14.2kJ/mol;則反應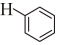 (g)+H2O(g)→
(g)+H2O(g)→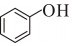 (l)+H2(g)的反應熱ΔH為( )
(l)+H2(g)的反應熱ΔH為( )A.-7.1kJ/mol B.+7.1kJ/mol C.-21.3kJ/mol D.+21.3kJ/mol 組卷:4引用:1難度:0.8 -
4.下列四種情況中組合后,任何溫度下反應均不能自發進行的是( )
①反應吸熱
②反應放熱
③反應后熵增加
④反應后熵減小A.①③ B.②③ C.②④ D.①④ 組卷:93引用:1難度:0.7 -
5.下列各組數據能體現可逆反應CH4(g)+2H2O(g)?CO2(g)+4H2(g)ΔH=-206kJ?mol-1達到平衡后,降溫的瞬間反應速率的大小關系的是( )
A.v正(CH4)=0.2mol(L?min)-1、v逆(H2)=2mol(L?min)-1 B.v正(CO2)=0.1mol(L?min)-1、v逆(H2O)=0.2mol(L?min)-1 C.v正(H2)=5mol(L?min)-1、v逆(H2O)=2mol(L?min)-1 D.v正(CO2)=1mol(L?min)-1、v逆(H2)=5mol(L?min)-1 組卷:0引用:1難度:0.5 -
6.下列事實不能用勒夏特列原理來解釋的是( )
A.在2Fe3++2I-?2Fe2++I2平衡溶液中,加入CCl4,Fe3+的轉化率提高 B.碳酸鈉去油污時,選用熱水去污效果更好 C.H2、I2、HI混合氣體平衡體系加壓后顏色加深:H2(g)+I2(g)?2HI(g) D.向K2Cr2O4溶液中滴入濃的NaOH溶液后,溶液黃色加深:2CrO42-(黃色)+2H+?Cr2O72(橙色)+H2O 組卷:3引用:1難度:0.5
二、非選擇題(本大題共4小題,共52分)
-
19.與石油資源相比,我國的煤炭資源相對比較豐富,因此對煤炭資源的合理開發利用尤為重要。
(1)燃煤發電即火力發電是煤的一種利用方式。工作原理如下,在燃燒的過程中,通常將塊狀煤粉碎,從速率的角度,主要目的是。
煤炭產生熱能燃燒產生水蒸氣加熱鍋爐產生電流驅動渦輪機
(2)煤的綜合利用的常見方式為液化和氣化: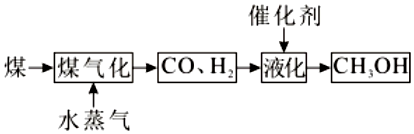
①將煤氣化或液化再使用的主要優點有(任答一點)。
②已知煤的氣化、液化的熱化學方程式分別為:
C(s)+H2O(g)═CO(g)+H2(g)ΔH1=xkJ/mol
CO(g)+2H2(g)═CH3OH(l)ΔH2=ykJ/mol
則煤的一種直接液化的熱化學方程式為:C(s)+H2O(g)+H2(g)═CH3OH(l)ΔH=。
(3)將CO2催化加氫可合成低碳烯烴是實現碳中和有效手段之一,例如:6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)ΔH。催化劑
①已知:2H2(g)+O2(g)=2H2O(g)ΔH2=-480kJ?mol-1。反應CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(g)△H3的相關鍵能數據:
則ΔH=共價鍵 C=O C-H C=C H-O O=O 鍵能/(kJ?mol-1) 745 413.4 615 463 494 。
②已知反應6H2(g)+2CO2(g)CH2=CH2(g)+4H2O(g)的v正=k正p2(CO2)?p6(H2)、v逆=k逆p(C2H4)?p4(H2O),該反應在T1℃溫度下,k正=1.5k逆,則該溫度時的Kp=催化劑。若T2℃溫度下,k正=2k逆,則T2T1(填“>”、“<”或“=”),理由為。
(4)煤炭中含有硫元素,燃燒過程中會產生SO2對環境造成嚴重污染。可用足量石灰乳進行吸收,反應的化學方程式為。若所得溶液的pH為11,c(Ca2+)=3×10-3molL,則溶液中c(SO32-)=,c(HSO3-)=。(已知:H2SO3的電離常數:K1=1.5×10-2,K2=1×10-7、CaSO3的溶度積:Ksp=3×10-7)組卷:1引用:1難度:0.6 -
20.乙二酸(H2C2O4)俗稱草酸,在實驗研究和化學工業中應用廣泛。回答下列各題:
(1)已知幾種常見弱酸的電離平衡常數(25℃)
①表中5種酸中,酸性最強的酸是酸 CH3COOH H2CO3 HCN HClO 草酸(H2C2O4) 電離平衡常數(Ka) 1.8×10-5 K1=4.4×10-7
K2=4.7×10-115×10-10 3×10-8 K1=5.4×10-2
K2=5.4×10-5,酸性最弱的酸是。
②寫出下列反應的離子方程式:CH3COOH與NaCN反應﹔少量草酸與CH3COONa反應;
(2)20℃時,在H2C2O4溶液中加入NaOH溶液,溶液中含碳元素微粒的分布分數δ隨溶液pH變化的關系如圖1所示。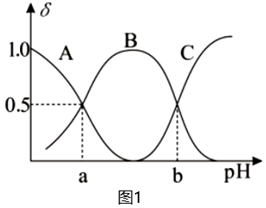
①圖中曲線B表示的微粒是。
②a點對應的pH為(已知1g5.4=0.73)。
(3)向20mL0.2mol?L-1H2C2O4溶液中滴加0.2mol?L-1NaOH溶液,溶液pH與滴加的NaOH溶液的體積關系如圖2。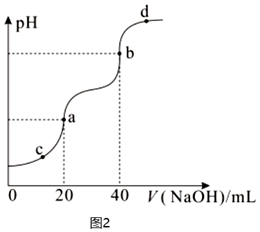
①a、b、c、d四點中,水的電離程度最大的是;
②a點溶液c(H2C2O4)(填“>”、“<”或“=”)c(C2O42-)。
(4)工業上利用硫酸亞鐵與草酸反應制備草酸亞鐵晶體,其離子方程式為:Fe2++H2C2O4?FeC2O4↓+2H+,已知FeC2O4的Ksp為2.1×10-7,則該反應的平衡常數表達式為,數值為(保留一位小數)。組卷:11引用:1難度:0.5


