2018-2019學年廣東省廣州市石化中學高二(上)期中化學試卷(理科)
發布:2024/4/20 14:35:0
一、選擇題(本題包括15小題,每小題3分,共45分。每小題只有一個選項符合題意。)
-
1.下列敘述中,能證明醋酸是弱電解質的是( )
A.醋酸中滴入石蕊溶液呈紅色 B.導電能力很差 C.醋酸溶液中CH3COOH、CH3COO-、H+共存 D.不是離子化合物,是共價化合物 組卷:3引用:1難度:0.7 -
2.一定溫度下在容積恒定的密閉容器中,加入B物質,進行如下可逆反應:2B(g)?C(g)+2D(g)。下列說法不能表明該反應已達到平衡狀態的是( )
A.v正(C):v逆(D)=1:2 B.密閉容器中D氣體的體積分數不變 C.容器內氣體的密度不變 D.容器內壓強不變 組卷:72引用:1難度:0.3 -
3.下列說法不正確的是( )
A.Na與H2O的反應是熵增的放熱反應,該反應能自發進行 B.同一化學反應,化學計量數不同,熱效應數值不同 C.由C(石墨)=C(金剛石) ΔH=+1.9 kJ?mol-1可知,石墨比金剛石穩定 D.同溫同壓下,H2(g)+Cl2 (g)=2HCl(g)在光照和點燃條件下的ΔH不同 組卷:0引用:1難度:0.7 -
4.下列敘述正確的是( )
A.使用催化劑能夠降低化學反應的反應熱△H B.CO(g)的燃燒熱是283kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的ΔH=+566kJ/mol C.需要加熱才能發生的反應一定是吸熱反應 D.中和熱ΔH=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱ΔH=-2×57.3kJ/mol 組卷:1引用:1難度:0.6 -
5.在恒容條件下,反應2HI(g)?H2(g)+I2(g)△H>0,達到平衡時,一定能使混合氣體的顏色加深,可采取的措施是:( )
①加催化劑
②升高溫度
③降低溫度
④增大氫氣濃度
⑤增大HI的濃度
⑥增大壓強A.②⑤ B.②⑤⑥ C.①③ D.③⑤⑥ 組卷:0引用:1難度:0.5 -
6.下列現象不能用勒夏特列原理解釋的是( )
A.工業上合成氨:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,采用高壓的條件 B.長時間光照氯水,顏色變淺 C.反應H2(g)+I2(g)?2HI(g),平衡后,壓縮體積,顏色變深 D.排飽和食鹽水法收集氯氣 組卷:3引用:1難度:0.5
二.第II卷非選擇題(共55分)
-
18.工業燃燒煤、石油等化石燃料釋放出大量氮氧化物(NOx)、CO2、SO2等氣體,嚴重污染空氣。通過對廢氣進行脫硝、脫碳和脫硫處理可實現綠色環保、廢物利用。
(1)甲醇不僅是重要的化工原料,而且還是性能優良的能源和車用燃料。甲醇和水蒸氣制取H2 的反應如下:
反應Ⅰ(主):CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H1 平衡常數為K1
反應Ⅱ(副):H2(g)+CO2(g)?CO(g)+H2O(g)△H2 平衡常數為K2
反應Ⅲ:CH3OH(g)?CO(g)+2H2(g)△H3 平衡常數為K3
反應Ⅰ的△H1=(用△H2、△H3表示),平衡常數K1=(用K2、K3表示)
(2)向2 L密閉容器中加入2molCO2和6molH2,在適當的催化劑作用下,下列反應能自發進行:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)。
①該反應ΔH0(填“>”、“<”或“=”)
②下列敘述能說明此反應達到平衡狀態的是。(填字母)
A.混合氣體的平均相對分子質量保持不變
B.CO2的轉化率和H2的轉化率相等
C.1mol CO2生成的同時有3mol H-H鍵斷裂
D.混合氣體的密度保持不變
③反應CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在體積相同(2L)的兩密閉容器中,改變條件,反應過程中部分數據見下表:
反應Ⅰ,前10min內的平均反應速率v(H2)=反應時間 CO2/mol H2/mol CH3OH/mol H2O/mol 反應Ⅰ:300K 0 min 2 6 0 0 10 min 4.5 20 min 1 30 min 1 反應Ⅱ:500K 0 min 0 0 2 2 。達到平衡時,反應Ⅰ、Ⅱ對比:平衡常數K(I)K(Ⅱ)(填“>”、“<”或“=”);平衡時CH3OH的濃度c(I)c(Ⅱ)(填“>”、“<”或“=”)。
(3)消除汽車尾氣的反應式之一為:2CO(g)+2NO(g)?N2(g)+2CO2(g)。在溫度T1時,將1.40molCO與1.60molNO充入一體積為2L的密閉容器中,反應平衡后N2的物質的量分數為0.25。求NO的平衡轉化率α1和反應平衡常數K(寫出計算過程)。組卷:2引用:3難度:0.5 -
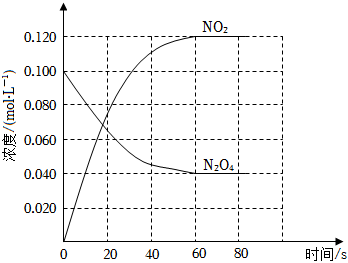 19.在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深。回答下列問題:
19.在容積為1.00L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2(g),隨溫度升高,混合氣體的顏色變深。回答下列問題:
(1)反應的△H0(填“大于”、“小于”);100℃時,體系中各物質濃度隨時間變化如上圖所示。在0~60s時段,反應速率v(N2O4)為mol?L-1?s-1,反應的平衡常數K1為。
(2)100℃時達到平衡后,改變反應溫度為T,c(N2O4)以0.0020mol?L-1?s-1的平均速率降低,經10s又達到平衡。
①T100℃。(填“大于”、“小于”)
②列式計算溫度T時反應的平衡常數K2。組卷:5引用:2難度:0.5


