2021-2022學年黑龍江省齊齊哈爾八中高二(下)開學化學試卷
發布:2024/4/20 14:35:0
一、單選題(本題包括16個小題,每小題3分,共計48分)
-
1.下列說法不正確的是( )
A.基態碳原子的核外電子軌道表示式: 
B.基態原子的核外電子填充在6個軌道中的元素有兩種 C.基態銅原子簡化電子排布式表示為[Ar]3d94s2違背了泡利原理 D.基態鉀離子(K+)電子占據的最高能級共有3個原子軌道,其形狀是啞鈴形 組卷:55引用:2難度:0.8 -
2.下列屬于基態排布的原子或離子核外電子排布式的是( )
A.Br-:3d104s24p6 B.Cr:[Ar]3d54s1 C.Na:1s22s22p53s2 D.Fe2+:[Ar]3d64s2 組卷:20引用:4難度:0.8 -
3.按照核外電子排布,可把元素周期表劃分為5個區。下列元素中,與其他元素不處在同一個區的是( )
A.Ne B.Al C.Pb D.Cu 組卷:12引用:3難度:0.9 -
4.短周期主族元素X、Y、Z、W的原子序數依次增大,X元素價電子排布式為2s22p2,Z元素原子的2p能級上有2個未成對電子,W與Z同主族。下列說法錯誤的是( )
A.元素Y在元素周期表中位于第2周期第ⅤA族 B.元素的電負性:X<Y<Z C.元素W的氧化物的水化物一定是強酸 D.四種元素中,元素X形成的化合物的種類最多 組卷:32引用:3難度:0.5 -
5.NCl3的水解反應方程式為:NCl3+H2O═HClO+NH3,下列說法正確的是( )
A.元素第一電離能:O>N B.氧原子的最高能級軌道形狀為球形 C.基態氯原子的價電子軌道表示式為: 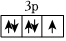
D.元素的電負性:O>Cl 組卷:26引用:2難度:0.7 -
6.短周期主族元素X、Y、Z、W的原子序數依次增大,X的族序數是周期序數的3倍,基態時Y原子3s原子軌道上有1個電子,Z與X處于同一主族。下列說法正確的是( )
A.原子半徑:r(W)<r(Z)<r(Y) B.第一電離能:I1(Y)<I1(X)<I1(Z) C.X與Y形成的化合物一定只含有離子鍵 D.W的最高價氧化物對應水化物的酸性比Z的弱 組卷:18引用:5難度:0.5
二、填空題(本題包括4個小題,共計52分)
-
19.鎳(Ni)及其化合物廣泛應用于生產電池、電鍍和催化劑等領域。
(1)NiSO4?6H2O晶體是一種綠色易溶于水的晶體,廣泛用于化學鍍鎳、生產電池等,可由電鍍廢渣(除含鎳外,還含有Cu2+、Zn2+、Fe2+等)為原料獲得。操作步驟如圖1: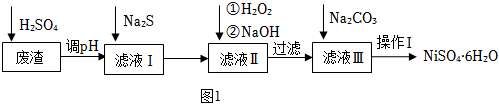
①加入Na2S的目的是。[已知:Ksp(FeS)=6.4×10-18,Ksp(CuS)=1.3×10-36,Ksp(ZnS)=1.3×10-24,Ksp(NiS)=1.1×10-21]
②可用氯酸鈉NaClO3代替H2O2,寫出氨酸鈉與濾液Ⅱ反應的離子方程式為。
③向濾液Ⅱ中加入NaOH調節pH在一范圍內生成氫氧化鐵沉淀。已知常溫下Fe(OH)3的Ksp=1.0×10-30,若要使溶液中c(Fe3+)≤1.0×10-6mol?L-1,則應該控制溶液pH范圍不小于。
(2)雙膜三室電解法處理含鎳廢水并回收金屬鎳的原理如圖2所示: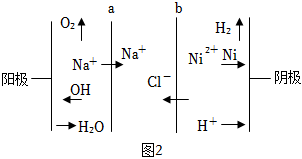
判斷a是(填“陽膜”或“陰膜”);電解過程中,需要控制溶液pH為4左右,原因是。組卷:13引用:2難度:0.5
三、(14分)實驗題
-
20.某小組同學探究物質的溶解度大小與沉淀轉化方向之間的關系。已知:
(1)探究BaCO3和BaSO4之間的轉化,實驗操作:物質 BaSO4 BaCO3 AgI AgCl 溶解度/g
(20℃)2.4×10-4 1.4×10-3 3.0×10-7 1.5×10-4
①實驗Ⅰ說明BaCO3全部轉化為BaSO4,依據的現象是加入鹽酸后,試劑A 試劑B 試劑C 加入鹽酸后的現象 實驗Ⅰ BaCl2 Na2CO3 Na2SO4 …… 實驗Ⅱ Na2SO4 Na2CO3 有少量氣泡產生,沉淀部分溶解
②實驗Ⅱ中加入稀鹽酸后發生反應的離子方程式是。
③實驗Ⅱ說明沉淀發生了部分轉化,結合BaSO4的沉淀溶解平衡解釋原因:
(2)探究AgCl和AgI之間的轉化,實驗Ⅲ:
實驗Ⅳ:在試管中進行溶液間反應時,同學們無法觀察到AgI轉化為AgCl,于是又設計了如下實驗(電壓表讀數:a>c>b>0)。
注:其他條件不變時,參與原電池反應的氧化劑(或還原劑)的氧化性(或還原性)越強,原電池的電壓越大;離子的氧化性(或還原性)強弱與其濃度有關。裝置 步驟 電壓表讀數 
i如圖連接裝置并加入試劑,閉合K a ii向B中滴入AgNO3(aq),至沉淀完全 b iii再向B中投入一定量NaCl(s) c ⅳ重復i,再向B中加入與iii等量a
NaCl(s)a
①實驗Ⅲ證明了AgCl轉化為AgI,甲溶液可以是(填序號)。
a.AgNO3溶液 b.NaCl溶液 c.KI溶液
②實驗Ⅳ的步驟ⅰ中,B中石墨上的電極反應式是
③結合信息,解釋實驗Ⅳ中b<a的原因:。
④實驗Ⅳ的現象能說明AgI轉化為AgCl,理由是組卷:72引用:4難度:0.6


