2012-2013學年湖北省赤壁一中高三(上)化學寒假作業(三)
發布:2024/11/18 11:0:1
一.選擇題(每小題只有一個正確答案,18×3=54分)
-
1.下列關于膠體的敘述,不正確的是( )
A.膠體中分散質粒子直徑大小在1~100 nm之間 B.可以利用丁達爾效應區分膠體和溶液 C.可利用過濾的方法分離膠體和溶液 D.膠體在一定條件下可以穩定存在 組卷:14引用:2難度:0.7 -
2.用NA表示阿伏加德羅常數,下列說法中正確的是( )
①18g D2O含有的電子數為10NA
②同溫、同壓下,相同體積的氟氣和氬氣所含的原子數相等
③標準狀況下,11.2L以任意比例混合的氮氣和氧氣所含的原子數為NA
④在標準狀況下,22.4LSO3的物質的量為1mol
⑤等物質的量的Na2O和Na2O2中含有的陰離子總數相等
⑥0.1molOH-含0.1NA個電子
⑦1mol Na2O2與水完全反應時轉移電子數為2NA.A.③⑤⑥⑦ B.③⑤ C.①②④⑦ D.③④⑤⑥ 組卷:16引用:4難度:0.9 -
3.依據元素周期表及元素周期律,下列推斷正確的是( )
A.H3BO3的酸性比H2CO3的強 B.Mg(OH)2的堿性比Be(OH)2的強 C.HCl、HBr、HI的熱穩定性依次增強 D.若M+和R2-的核外電子層結構相同,則原子序數:R>M 組卷:665引用:61難度:0.9 -
4.相同溫度下,兩種氨水A、B,濃度分別是0.2mol/L和0.1mol/L,則A和B的OH-濃度之比( )
A.大于2 B.小于2 C.等于2 D.不能確定 組卷:130引用:13難度:0.9 -
5.將足量CO2通入下列各溶液中,所含離子還能大量共存的是( )
A.K+、 、Cl-、SiO2-3NO-3B.H+、 、Al3+、NH+4SO2-4C.Na+、S2-、OH-、 SO2-4D.Na+、C6H5O-、CH3COO-、 HCO-3組卷:15引用:8難度:0.7 -
6.某反應的△H=+100kJ?mol-1,下列有關該反應的敘述正確的是( )
A.正反應活化能小于100kJ?mol-1 B.逆反應活化能一定小于100kJ?mol-1 C.正反應活化能不小于100kJ?mol-1 D.正反應活化能比逆反應活化能大100kJ?mol-1 組卷:78引用:23難度:0.7 -
7.在配制一定物質的量濃度的NaOH溶液時,會造成所配溶液濃度偏高的是( )
A.容量瓶中原有少量蒸餾水 B.定容時俯視刻度線 C.有少量NaOH溶液殘留在燒杯里 D.稱量時誤操作為“左碼右物” 組卷:7引用:1難度:0.8
二、解答題(共3小題,滿分46分)
-
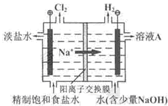 20.氯堿工業中電解飽和食鹽水的原理示意圖如右圖所示.
20.氯堿工業中電解飽和食鹽水的原理示意圖如右圖所示.
(1)溶液A的溶質是.
(2)電解飽和食鹽水的離子方程式是.
(3)電解時用鹽酸控制陽極區溶液的pH在2~3.用化學平衡移動原理解釋鹽酸的作用:.
(4)電解所用的鹽水需精制,去除有影響的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精制流程如下(淡鹽水和溶液A來自電解池):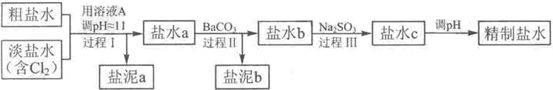
①鹽泥a除泥沙外,還含有的物質是.
②過程I中將NH4+轉化為N2的離子方程式是.
③BaSO4的溶解度比BaCO3的小.過程II中除去的離子有.
④經過程III處理,要求鹽水c中剩余Na2SO3的含量小于5mg/L.若鹽水b中NaClO的含量是7.45mg/L,則處理10m3鹽水b,至多添加10% Na2SO3溶液kg(溶液體積變化忽略不計).組卷:373引用:7難度:0.6 -
21.為證明Fe3+具有較強的氧化性,甲同學做了如下實驗:將Cu片放入Fe(NO3)3溶液中,觀察到Cu片逐漸溶解,溶液由黃色變為藍綠色,由此甲同學得到Fe3+具有較強氧化性的結論.
乙同學提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性條件下NO3-也能氧化Cu”,并設計實驗進行探究.
已知:
請回答:水解反應 平衡常數(K) Fe3++3H2O?Fe(OH)3+3H+ 7.9×10-4 Fe2++2H2O?Fe(OH)2+2H+ 3.2×10-10 Cu2++2H2O?Cu(OH)2+2H+ 3.2×10-7
(1)稀硝酸和Cu反應的化學方程式為.
(2)請利用所提供的試劑,幫助乙同學完成實驗方案設計.
試劑:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH試紙(0.5~5.0)、稀硝酸
方案:.
(3)丙同學分別實施了甲、乙兩位同學的實驗方案,并在實驗過程中用pH計監測溶液pH的變化,實驗記錄如下.
①根據實驗現象寫出發生反應的離子方程式:實驗內容 實驗現象 甲同學的實驗方案 溶液逐漸變成藍綠色,pH略有上升 乙同學的實驗方案 無明顯現象,pH沒有明顯變化. .
②導致實驗過程中溶液pH略有上升的可能原因是.
(4)請你設計更簡便可行的實驗方案,幫助甲同學達到實驗目的:.組卷:4引用:2難度:0.1


