2021-2022學年河北省秦皇島市盧龍第二高級中學高二(上)期末化學試卷
發布:2024/11/4 18:0:2
一、選擇題:本題共10小題,每小題3分,共30分。每小題只有一個選項符合題意。
-
1.H2與O2發生反應的過程用模型圖示如下(“-”表示化學鍵):下列說法不正確的是( )
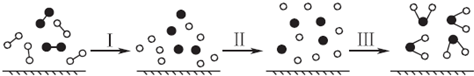
A.過程Ⅰ是吸熱過程 B.過程Ⅲ一定是放熱過程 C.該反應過程所有舊化學鍵都斷裂,且形成了新化學鍵 D.該反應的能量轉化形式只能以熱能的形式進行 組卷:413引用:40難度:0.9 -
2.有平衡體系:CO(g)+2H2(g)?CH3OH(g)ΔH<0,為了增加甲醇(CH3OH)單位時間的產量,應采用的最佳反應條件是( )
A.高溫、高壓 B.低溫、高壓、催化劑 C.低溫、低壓 D.適宜溫度、高壓、催化劑 組卷:17引用:3難度:0.5 -
3.N2O和CO是環境污染性氣體,可在Pt2O+表面轉化為無害氣體,其反應為N2O(g)+CO(g)?CO2(g)+N2(g)ΔH,有關化學反應的物質變化過程(圖1)及能量變化過程(圖2)如圖,下列說法正確的是( )
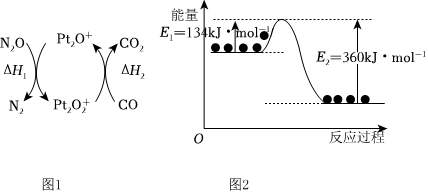
A.由圖1可知:ΔH1=ΔH-ΔH2 B.由圖2可知ΔH=+226 kJ?mol-1 C.為了實現轉化需不斷向反應器中補充Pt2O+和Pt2 O+2D.由圖2可知該反應正反應的活化能大于逆反應的活化能 組卷:9引用:3難度:0.5 -
4.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol?L-1的溶液 C.c(H+)水=c(OH-)水的溶液 D.常溫下pH=2的鹽酸與pH=12的氨水等體積混合后的溶液 組卷:64引用:4難度:0.7 -
5.在恒溫恒容的密閉容器中發生反應4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0,下列能說明該反應達到平衡狀態的是( )
①反應速率5v(NH3)=4v(O2)
②體系的壓強不再發生變化
③混合氣體的密度不再發生變化
④氣體的平均摩爾質量不變
⑤單位時間內生成5mol O2同時斷裂12mol O-H鍵
⑥NO的濃度不變A.②④⑥ B.①②④⑥ C.②⑤⑥ D.①②③④⑤ 組卷:228引用:6難度:0.7 -
6.反應A(g)+3B(g)=2C(g)+2D(g)在四種不同情況下的反應速率分別為
①v(A)=0.45mol?L-1?s-1
②v(B)=0.6mol?L-1?s-1
③v(C)=0.4mol?L-1?s-1
④v(D)=0.45mol?L-1?s-1。
下列有關反應速率的比較中正確的是( )A.④>③=②>① B.①>④>②=③ C.①>②>③>④ D.④>③>②>① 組卷:26引用:3難度:0.6
三、非選擇題:本題共4小題,共50分。
-
18.氨氣廣泛應用于化肥、制藥、合成纖維等領域。
Ⅰ.工業上可由氫氣和氮氣合成氨氣。若用 、
、 、
、 、
、 分別表示N2、H2、NH3和催化劑,則在催化劑表面合成氨的過程如圖1所示:
分別表示N2、H2、NH3和催化劑,則在催化劑表面合成氨的過程如圖1所示: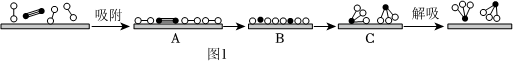
(1)吸附后,能量狀態最高的是(填序號)。
(2)結合上述過程,一定溫度下在固體催化劑表面進行NH3的分解實驗,發現NH3的分解速率與濃度的關系如2圖所示。從吸附和解吸過程分析,c0前反應速率增加的原因可能是;c0之后反應速率降低的原因可能是。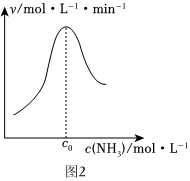
Ⅱ.利用NH3在催化劑(V2O5-WO3/TiO2)作用下將NOx還原為N2是目前應用最為廣泛的氮氧化物NOx的凈化方法,其原理是:
主反應:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)ΔH1
副反應:4NH3(g)+3O2(g)?2N2(g)+6H2O(g)ΔH2
(3)根據蓋斯定律可得:4NH3(g)+6NO(g)?5N2(g)+6H2O(g)ΔH3,則ΔH3=(用含ΔH1、ΔH2的式子表示)。
(4)催化劑V2O5-WO3/TiO2中的V2O5是活性組分。在反應器中以一定流速通過混合氣[n(O2):n(NH3):n(NO)=71:1:1],在不同溫度下進行該催化反應,V2O5的質量分數對單位時間內NO去除率的影響如圖3所示。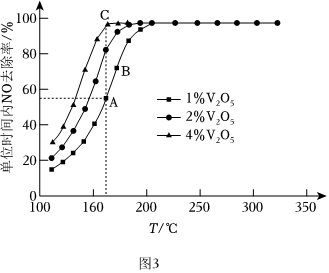
①從起始至對應A、B、C三點的平均反應速率由小到大的順序為。
②V2O5的質量分數對該催化劑活性的影響是。
(5)一定溫度下,向1L恒容密閉容器(含催化劑)中投入1molNH3和1.5molNO,發生反應4NH3(g)+6NO(g)?5N2(g)+6H2O(g)。達到平衡狀態時,NO的轉化率為60%,則平衡常數為mol?L-1(列出計算式即可)。組卷:23引用:4難度:0.6 -
19.合成氨技術的創立開辟了人工固氮的重要途徑,解決了億萬人口生存問題。回答下列問題:

(1)科學家研究利用鐵觸媒催化合成氨的反應歷程如圖所示,其中吸附在催化劑表面的物種用“ad”標記。由圖可知合成氨反應的熱化學方程式為,寫出該歷程中速率最慢一步的反應。
(2)工業合成氨反應為:N2(g)+3H2(g)?2NH3(g),當進料體積比V(N2):V(H2)=1:3時,平衡氣體中NH3的物質的量分數隨溫度和壓強變化的關系如圖所示:
①該反應的平衡常數K(a)K(b)(填“<”或“=”或“>”)。
②500℃、壓強為5P0時,Kp=[Kp為平衡分壓代替平衡濃度計算求得的平衡常數(分壓=總壓×物質的量分數)]。
(3)科學家利用生物燃料電池原理研究室溫下氨的合成并取得初步成果,電池工作時MV2+/MV+在電極與酶之間傳遞電子,示意圖如圖所示。
①A電極反應為。
②電池工作時在固氮酶表面發生的反應為。組卷:15引用:2難度:0.6


