2020-2021學年湖南省長沙市南雅中學高二(上)入學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共16小題,每小題3分,滿分48分)
-
1.下列變化過程,屬于放熱反應的是( )
①NH4Cl固體溶于水②炸藥爆炸③食物因氧化而腐敗④鋁熱反應⑤酸堿中和反應⑥煅燒石灰石制生石灰⑦溴蒸氣液化A.②③④⑤⑦ B.①②④⑤ C.②③④⑤ D.①②③⑥⑦ 組卷:57引用:4難度:0.8 -
2.近年來,有科學家結合正電子發射斷層顯像技術(PET-CT)技術,發現了抑郁癥、癡呆、認知障礙患者腦部功能性異常,給這類疾病的治療帶來了新的方向。PET-CT的檢查需要患者事先服用被18F標記的藥物分子,下列關于18F說法正確的是( )
A.18F的性質與常見的19F性質完全相同 B.18F的質量數與18O的質量數相同 C.18F原子中有9個質子,9個中子,18個電子 D.18F與18O互為同位素 組卷:40引用:2難度:0.8 -
3.某科研團隊研制出“TM-LiH(TM表示過渡金屬)”雙催化劑體系,顯著提高了在溫和條件下氮氣和氫氣合成NH3的效率,原理示意如下:
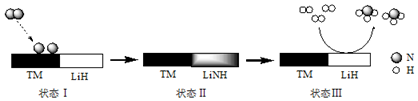
下列分析不合理的是( )A.狀態Ⅰ,吸收能量并有N≡N鍵發生斷裂 B.合成NH3總反應的原子利用率是100% C.“TM-LiH”能降低合成氨反應的△H D.生成NH3:2LiNH+3H2═2LiH+2NH3 組卷:181引用:19難度:0.5 -
4.應用元素周期律的有關知識,可以預測我們未知的一些元素及其化合物的性質。下列預測錯誤的是( )
A.硒(Se)是第ⅥA族元素,其氫化物的熔沸點:H2Se>H2S>H2O B.鉍(Bi)與氮同主族,其最高價氧化物的水化物為弱堿 C.砹單質是一種有色固體,砹化氫很不穩定 D.鍶(Sr)是第ⅡA族元素,其最高價氧化物對應的水化物是強堿 組卷:15引用:2難度:0.5 -
5.四種短周期元素W、X、Y、Z的原子序數依次增大,其原子的最外層電子數之和為19,W和X元素原子內質子數之比為1:2,X2+和Z-的電子數之差為8.下列說法不正確的是( )
A.X與Z通過離子鍵形成離子化合物 B.元素原子半徑從大到小的順序是W>X>Y>Z C.WZ4分子中W、Z原子通過共價鍵結合且最外層均達到8電子結構 D.W、Y、Z元素最高價氧化物對應的水化物中酸性最強的是Z 組卷:17引用:2難度:0.5 -
6.部分短周期元素的原子半徑及主要化合價如表所示,則下列說法中正確的是( )
元素代號 L M Q R T 原子半徑/nm 0.166 0.143 0.112 0.104 0.066 主要化合價 +2 +3 +2 +6、-2 -2 A.M與Q在同一周期 B.L單質與稀鹽酸反應不如Q劇烈 C.M與T形成的化合物具有兩性 D.L2+與R2-的核外電子數相等 組卷:9引用:2難度:0.5 -
7.以下是反應A(g)+3B(g)?2C(g)+2D(g)在四種不同情況下的反應速率,反應速率最大的是( )
A.υ(A)=0.5mol?L-1?s-1 B.υ(B)=0.3mol?L-1?min-1 C.υ(C)=0.6mol?L-1?s-1 D.υ(D)=0.8mol?L-1?min-1 組卷:21引用:2難度:0.5
二、解答題(共6小題,滿分52分)
-
21.已知25℃時部分弱電解質的電離平衡常數數據如表所示,回答下列問題:
(1)表中三種酸酸性最強的是化學式 CH3COOH H2CO3 HClO 電離平衡常數 Ka=1.8×10-5 Ka1=4.3×10-7
Ka2=5.6×10-11Ka=3.0×10-8 。
(2)常溫下,0.1mol?L-1CH3COOH溶液加水稀釋過程中,下列表達式的數據變大的是。(填字母)
A.c(H+)
B.c(H+)c(CH3COOH)
C.c(OH-)c(H+)
D.c(H+)?c(CH3COO-)c(CH3COOH)
(3)寫出向次氯酸鈉溶液中通入少量二氧化碳的離子方程式:。
(4)25℃時,將amol?L-1的醋酸與bmol?L-1氫氧化鈉等體積混合,反應后溶液恰好顯中性,這時鈉離子濃度與醋酸根離子濃度相等,用a、b表示醋酸的電離平衡常數為。組卷:28引用:2難度:0.5 -
22.CO是大氣污染氣體,可利用化學反應進行治理或轉化。
(1)甲醇是重要的溶劑和燃料,工業上用CO和H2在一定條件下制備CH3OH的反應為:CO(g)+2H2(g)?CH3OH(g)△H<0。
①T℃時,向容積為2L的恒容密閉容器中充入1mol CO和1.2mol H2,一段時間后達到平衡,此時H2與CH3OH的體積分數之比為2:5,該反應的平衡常數K=;此時若向容器中再通入0.4mol CO和0.2mol CH3OH(g),則平衡將移動。(填“向正反應方向”、“不”或“向逆反應方向”)
②在一容積可變的密閉容器中充入一定物質的量的CO和H2,測得CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。a、b、c三點平衡常數K(a)、K(b)、K(c)的大小關系是。
(2)瀝青混凝土可作為2CO(g)+O2(g)?2CO2(g)反應的催化劑。如圖表示在相同的恒容密閉容器、相
同起始濃度、反應相同的時間,使用同質量的不同瀝青混凝土(α型、β型)催化時,CO的轉化率與溫度的關系。
①a、b、c、d四點中表示平衡狀態的是。
②e點轉化率出現突變的原因可能是。組卷:13引用:1難度:0.5


