2021-2022學(xué)年湖北省部分重點(diǎn)中學(xué)高三(上)起點(diǎn)化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共15小題,每小題3分,共45分。在每小題給出的四個(gè)選項(xiàng)中,只有一項(xiàng)是符合題目要求的。
-
1.化學(xué)與生活關(guān)系密切。下列說法不正確的是( )
A.牙膏中添加氟化物用于預(yù)防齲齒 B.玻璃相對(duì)易碎,打碎的玻璃屬于可回收垃圾 C.汽車尾氣催化轉(zhuǎn)化器可有效減少CO2的排放,實(shí)現(xiàn)“碳中和” D.葡萄酒中加入適量SO2有助于殺死葡萄自身攜帶的雜菌,防止微生物污染 組卷:12引用:1難度:0.6 -
2.日本福島第一核電站含有對(duì)海洋環(huán)境有害的核廢水,該廢水沒有完全清除的放射性元素帶來的風(fēng)險(xiǎn)很大,其中鍶—90易導(dǎo)致白血病,其衰變反應(yīng)為:
Sr→9038X+90ae(其半衰期為28年)。下列說法正確的是( )0-1A. Sr與9038X互為同位素90aB. Sr與9038X中子數(shù)相同90aC.42年后,核廢水中的 Sr的量為現(xiàn)在的903818D. Sr與9038Sr基態(tài)原子核外電子的空間運(yùn)動(dòng)狀態(tài)都有19種8738組卷:4引用:1難度:0.8 -
3.NA為阿伏加德羅常數(shù)的值.下列說法正確的是( )
A.常溫常壓下,46gNO2中所含的分子數(shù)目為NA B.常溫下,1LpH=1的鹽酸溶液,由水電離的H+離子數(shù)目為0.1NA C.鉛蓄電池中,當(dāng)正極增加6.4g時(shí),電路中通過的電子數(shù)目為0.2NA D.向FeI2溶液中通入適量Cl2,當(dāng)有1molFe2+被氧化時(shí),共轉(zhuǎn)移的電子數(shù)為3NA 組卷:7引用:2難度:0.7 -
4.下列離子方程式書寫不正確的是( )
A.向一定體積明礬溶液中滴加Ba(OH)2溶液,使硫酸根離子濃度降低到最小時(shí):Al3++2SO4-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O B.在硫酸酸化的KMnO4溶液中滴入雙氧水,溶液褪色:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O C.將過量NaOH溶液滴入到Ca(HCO3)2溶液中:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- D.向Ag(NH3)2OH溶液中滴入過量0.1mol/L硫氫化鉀溶液:2[Ag(NH3)2]++2OH-+6HS-=Ag2S↓+2H2O+4NH4++5S2- 組卷:25引用:2難度:0.5 -
5.短周期主族元素W、X、Y、Z、R的原子序數(shù)依次增大。W是唯一能形成裸露質(zhì)子的元素;X的簡(jiǎn)單氫化物與其最高價(jià)氧化物對(duì)應(yīng)的水化物能發(fā)生化合反應(yīng);W與Y形成的二元化合物通常作綠色氧化劑;Z的核電荷數(shù)是Y的2倍。下列說法正確的是( )
A.第一電離能:Z>X>Y B.1molY的最簡(jiǎn)單氫化物在固態(tài)狀況下可以形成氫鍵數(shù)目為4NA C.Z的一種同素異形體的結(jié)構(gòu)為 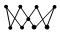 ,該物質(zhì)中Z原子雜化類型為sp3
,該物質(zhì)中Z原子雜化類型為sp3D.R存在四種含氧酸,相同條件下其氧化性隨中心原子化合價(jià)升高而增強(qiáng) 組卷:15引用:2難度:0.5 -
6.“接觸法制硫酸”的核心反應(yīng)是2SO2+O2?2SO3,因SO2在催化劑表面與O2接觸而得名,反應(yīng)過程示意圖如圖:
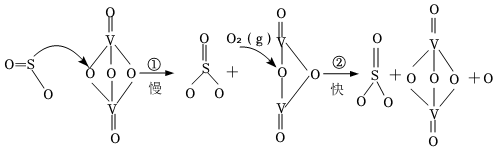
下列說法正確的是( )A.SO2、SO3中心原子雜化方式不同 B.總反應(yīng)的反應(yīng)速率由反應(yīng)②決定 C.圖示過程中既有V-O鍵的斷裂又有V-O鍵的形成 D.V2O4的作用是降低該反應(yīng)的活化能 組卷:12引用:1難度:0.7
二、非選擇題:本題共4小題,共55分。
-
 18.研究氮及其化合物的性質(zhì)及轉(zhuǎn)化,對(duì)研究自然界中氮的循環(huán)有著重大的意義。
18.研究氮及其化合物的性質(zhì)及轉(zhuǎn)化,對(duì)研究自然界中氮的循環(huán)有著重大的意義。
Ⅰ合成氨技術(shù)的創(chuàng)立開辟了人工固氮的重要途徑,解決了億萬人口生存問題。
工業(yè)合成氨方程式為:N2(g)+3H2(g)?2NH3(g)△H
我國科學(xué)家在合成氨反應(yīng)機(jī)理研究中取得新進(jìn)展,首次報(bào)道了Li-3d過渡金屬這一復(fù)合催化體系,并提出了“氮轉(zhuǎn)移”催化機(jī)理。
①3LiH(s)+N2(g)=Li2NH(s)+LiNH2(s)△H1=akJ?mol-1
②Li2NH(s)+2H2(g)=2LiH(s)+NH3(g)△H2=bkJ?mol-1
③LiNH2(s)+H2g)=LiH(s)+NH3(g)△H3=ckJ?mol-1
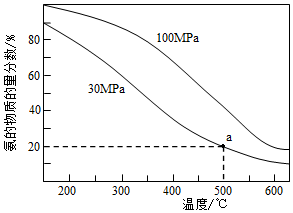
(1)當(dāng)進(jìn)料體積比V(N2):V(H2)=1:3時(shí),平衡氣體中NH3的物質(zhì)的量分?jǐn)?shù)隨溫度和壓強(qiáng)變化的關(guān)系如圖所示:則①N2(g)+3H2(g)?2NH3(g)△H=kJ?mol-1;該反應(yīng)屬于反應(yīng)填(“放熱”、“吸熱”),判斷理由。
②500℃時(shí),反應(yīng)的平衡常數(shù)Kp(100MPa)Kp(30MPa)。(填“大于”、“等于”、“小于”)
③500℃、30MPa時(shí),氫氣的平衡轉(zhuǎn)化率為(保留4位有效數(shù)字),Kp=(列出計(jì)算式即可)。[Kp為平衡分壓代替平衡濃度計(jì)算求得的平衡常數(shù)(分壓=總壓×物質(zhì)的量分?jǐn)?shù))]
Ⅱ.防治氮氧化物造成的空氣污染是目前環(huán)境保護(hù)領(lǐng)域的重要課題之一。
(2)用Pl-g-C3N4光催化氧化法脫除NO的過程如圖1所示。在酸性水溶液中,光催化脫除原理和電化學(xué)反應(yīng)原理類似。g-C3N4端的反應(yīng)為O2+2H++2e-=H2O2,則Pl端的反應(yīng)為。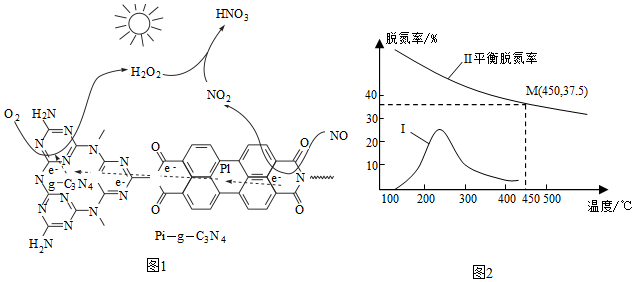
(3)將NO和CO的混合氣體(物質(zhì)的量之比1:1)以一定的流速通過催化劑a,相同時(shí)間、不同溫度下測(cè)得脫氮率與溫度的關(guān)系如圖2所示。
①曲線Ⅰ顯示隨著溫度升高脫氮率先增大后減小,其中減小的原因是。
②已知催化劑b活性高于催化劑a,且450℃下活性最大,若保持其它條件和反應(yīng)時(shí)間不變,用b替代a進(jìn)行上述實(shí)驗(yàn),則450℃下對(duì)應(yīng)的脫氮率37.5%(填“≤”、“<”、“無法判斷”)。組卷:21引用:2難度:0.5 -
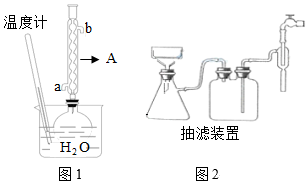 19.四碘化錫是一種橙紅色晶體,為共價(jià)型化合物,熔點(diǎn)144.5℃,沸點(diǎn)為364℃,受潮易水解,在空氣中也會(huì)緩慢水解;易溶于二硫化碳、三氯甲烷、四氯化碳、苯等有機(jī)溶劑中,在冰醋酸中溶解度較小。實(shí)驗(yàn)室制備四碘化錫的主要步驟如下:
19.四碘化錫是一種橙紅色晶體,為共價(jià)型化合物,熔點(diǎn)144.5℃,沸點(diǎn)為364℃,受潮易水解,在空氣中也會(huì)緩慢水解;易溶于二硫化碳、三氯甲烷、四氯化碳、苯等有機(jī)溶劑中,在冰醋酸中溶解度較小。實(shí)驗(yàn)室制備四碘化錫的主要步驟如下:
步驟1:在干燥的圓底燒瓶中加入1.500 g的碎錫箔和2.540 g I2,再加入30 mL冰醋酸和30 mL醋酸酐[(CH3CO)2O]。實(shí)驗(yàn)裝置如圖1所示,組裝好后裝置,打開冷卻水,加熱燒瓶至沸騰約1-1.5 h,直至反應(yīng)完成;
步驟2:冷卻結(jié)晶,用如圖2抽濾裝置過濾得到四碘化錫粗品;
步驟3:將所得粗品轉(zhuǎn)移到圓底燒瓶中加入30 mL氯仿,水浴加熱回流溶解后,趁熱抽濾,用氯仿洗凈布氏漏斗上殘留的Sn箔;
步驟4:將濾液和洗滌液倒入蒸發(fā)皿中,置于通風(fēng)櫥內(nèi),待氯仿全部揮發(fā)抽盡后,得到橙紅色四碘化錫晶體,稱得其質(zhì)量為2.508 g。
回答下列問題:
(1)圖1中儀器A的名稱為;冷卻水從接口(填“a”或“b”)流入儀器。
(2)圓底燒瓶的容積為較為合適。
A.1000 mL
B.500 mL
C.300 mL
D.100 mL
(3)步驟1當(dāng)出現(xiàn)現(xiàn)象時(shí),停止加熱。
(4)實(shí)驗(yàn)過程中加入冰醋酸作溶劑同時(shí)加入醋酸酐的目的是。
(5)根據(jù)實(shí)驗(yàn)數(shù)據(jù)計(jì)算,該產(chǎn)品的產(chǎn)率是。保留3位有效數(shù)字)
(6)指出該實(shí)驗(yàn)裝置(圖1)不足之處并加以改進(jìn)。組卷:13引用:1難度:0.5


