2021-2022學年江蘇省蘇州市高一(上)期中化學試卷
發布:2025/1/4 6:0:2
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.在工業生產與實驗操作中要具備良好的安全意識。下列所示危險化學品分類標志對應不正確的( )
A.  爆炸品
爆炸品B.  腐蝕品
腐蝕品C.  有毒品
有毒品D.  易燃物組卷:19引用:3難度:0.9
易燃物組卷:19引用:3難度:0.9 -
2.反應SO2+2NaOH═Na2SO3+H2O可用于處理SO2尾氣。下列有關化學用語或說法正確的是( )
A.SO2是酸性氧化物 B.S原子結構示意圖: 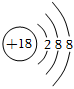
C.NaOH電離方程式:NaOH═Na++O2-+H+ D.Na2SO3的名稱:硫酸鈉 組卷:72引用:4難度:0.7 -
3.下列屬于化學變化的是( )
A.水蒸發 B.硫燃燒 C.氯氣液化 D.礦石粉碎 組卷:18引用:2難度:0.6 -
4.
C可以作為核聚變材料。下列關于136C的敘述正確的是( )136A. C和136C是同一種核素146B. C原子核內中子數為6136C. C原子核內質子數為13136D. C和136C互為同位素146組卷:143引用:6難度:0.8 -
5.下列反應不屬于四種基本反應類型,但屬于氧化還原反應的是( )
A.Fe+CuSO4═FeSO4+Cu B.Na2CO3+BaCl2═BaCO3↓+2NaCl C.Fe2O3+3CO 2Fe+3CO2高溫D.2H2O2 2H2O+O2↑MnO2組卷:50引用:5難度:0.7 -
6.化學與生產生活密切相關,下列說法不正確的是( )
A.利用丁達爾效應可鑒別Al(OH)3膠體和KCl溶液 B.電解飽和食鹽水可得到氫氧化鈉溶液 C.將Cl2通入澄清石灰水中可制得漂白粉 D.服用小蘇打片可以治療胃酸過多 組卷:22引用:2難度:0.7
二、非選擇題:共4題,共58分。
-
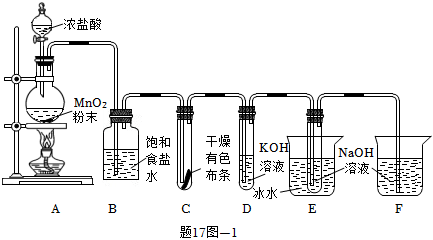
17.氯可形成多種含氧酸鹽,廣泛應用于殺菌、消毒及化工領域。實驗室中利用題17圖-1裝置(部分裝置省略)制得Cl2,進而制備少量KClO3和NaClO。
已知:Cl2與KOH溶液在70~80°C時反應生成KClO3,而在溫度較低時會反應生成KClO。
回答下列問題:
(1)裝置A中盛放濃鹽酸的儀器名稱是。
(2)A中制備Cl2的化學方程式為,該反應中氧化劑與還原劑的物質的量之比為。
(3)B中飽和食鹽水的作用是。C中的實驗現象是。
(4)D需要進行加熱,采用適宜的加熱方式是。
(5)E中反應的化學方程式為。
(6)F的作用是。
(7)若A裝置后連接如題17圖-2所示裝置,當反應結束關閉分液漏斗活塞后,關閉止水夾K,該裝置的作用是。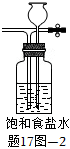 組卷:47引用:1難度:0.6
組卷:47引用:1難度:0.6 -
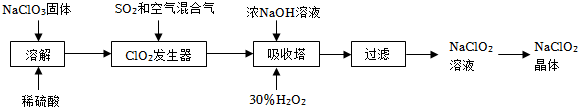
18.亞氯酸鈉(NaClO2)是一種殺菌漂白劑,可用于棉紡漂白,食品消毒,水處理等,消毒時本身被還原成Cl-。亞氯酸鈉晶體的一種生產工藝如圖:
已知:①ClO2濃度過高時易發生分解爆炸,一般用稀有氣體或空氣稀釋至含量 10%以下。
②NaClO2在溫度高于60°C時易分解生成NaClO3和NaCl。
(1)在“ClO2發生器”中,NaClO3與SO2反應生成ClO2和Na2SO4,該反應的化學方程式為。
(2)向“ClO2發生器”中鼓入空氣的作用是(填字母)。
a.將SO2氧化成SO3,增強酸性
b.將NaClO2氧化成ClO2
c.稀釋ClO2,以防分解爆炸
(3)“吸收塔”的作用是將產生的ClO2反應轉化為NaClO2,在此過程中加入的H2O2是作(填“氧化劑”或“還原劑”)。“吸收塔”中需要控制溫度不超過20°C,其原因。
(4)NaClO2的溶解度曲線如圖所示。從NaClO2溶液中獲得NaClO2晶體的操作是:將NaClO2溶液、,過濾,洗滌,干燥。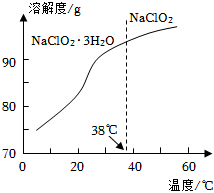
(5)為測定所得NaClO2產品的純度,進行如下實驗:
步驟①:取1.000 g樣品于燒杯中,用適量蒸餾水溶解后,加入略過量的KI晶體,再滴加適量的稀硫酸,充分反應;(反應方程式為:NaClO2+4KI+2H2SO4=2H2O+2I2+NaCl+2K2SO4)
步驟②:將所得溶液轉移至250mL容量瓶中,稀釋定容得溶液A;
步驟③:準確移取25.00 mL溶液A于錐形瓶中,向錐形瓶中滴加兩滴淀粉溶液作指示劑,用0.2000mol?L-1的Na2S2O3標準溶液與之反應,至恰好完全反應時消耗Na2S2O3溶液22.00mL。(反應方程式為:I2+2Na2S2O3=2NaI+Na2S4O6)
計算該NaClO2產品的純度(寫出計算過程)。組卷:75引用:1難度:0.5


