2022-2023學年廣東省廣州市育才中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(本題包括16小題,共44分。其中1—10小題,每小題2分,共20分;11—16小題,每小題
-
1.下列食品添加劑中,其使用目的與反應速率有關的是( )
A.抗氧化劑 B.調味劑 C.著色劑 D.增稠劑 組卷:1724引用:89難度:0.8 -
2.合成氨工業中采用循環操作,主要是為了( )
A.增大化學反應速率 B.使氨氣液化分離,使化學平衡向生成NH3的方向移動 C.提高氮氣和氫氣的利用率 D.提高平衡混合物中氨的含量 組卷:29引用:1難度:0.9 -
3.研究氮氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g) K1△H1<0;
2NO(g)+Cl2(g)?2ClNO(g) K2△H2<0。
則反應4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數是( )A. K21K2B.2K1-K2 C. 2K1K2D.K12-K2 組卷:56引用:1難度:0.7 -
4.某同學設計如圖所示實驗,探究反應中的能量變化。下列判斷正確的是( )

A.實驗①、②、③所涉及的反應都是放熱反應 B.實驗②反應物的總能量高于生成物的總能量 C.若用NaOH固體測定中和熱,則測定結果偏高 D.實驗③中將環形玻璃攪拌棒改為鐵質攪拌棒對實驗結果沒有影響 組卷:84引用:11難度:0.8 -
5.下列熱化學方程式正確的是( )
A.H2的燃燒熱為a kJ?mol-1 H2+Cl2 2HCl△H=-a kJ?mol-1點燃B.1 mol SO2、0.5 mol O2完全反應后,放出熱量98.3 kJ2SO2(g)+O2(g)═2SO3(g)△H=-98.3 kJ?mol-1 C.H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1
H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1D.31 g白磷比31 g紅磷能量多b kJ P4(s)═4P(s)△H=-4b kJ?mol-1 組卷:150引用:17難度:0.6 -
6.北魏賈思勰《齊民要術?作酢法》這樣描述苦酒:“烏梅苦酒法:烏梅去核,一升許肉,以五升苦酒漬數日,曝干,搗作屑。欲食,輒投水中,即成醋爾。”下列有關苦酒主要成分的說法正確的是( )
A.苦酒的主要溶質是非電解質 B.苦酒的主要溶質是弱電解質 C.苦酒的主要溶質是強電解質 D.苦酒的溶液中只存在分子,不存在離子 組卷:52引用:8難度:0.8
二、填空題(共4題,每題14分)
-
19.近年來我國大力加強溫室氣體CO2的轉化研究,如催化氫化合成甲醇技術的工業化量產研究,實現可持續發展。回答下列問題:
(1)已知:CO2(g)+H2(g)?H2O(g)+CO(g)ΔH1=+41.1kJ?mol-1
CO(g)+2H2(g)?CH3OH(g) ΔH2=-90.0kJ?mol-1
寫出CO2催化氫化合成甲醇的熱化學方程式。
(2)為提高CH3OH(g)的產率,理論上應采用的條件是(填序號)。
a.高溫高壓
b.低溫低壓
c.高溫低壓
d.低溫高壓
(3)250℃時,在恒容密閉容器中由CO2(g)催化氫化合成CH3OH(g),如圖為不同投料比[]時某反應物X的平衡轉化率的變化曲線。反應物X是n(H2)n(CO2)(填“CO2”或“H2”)。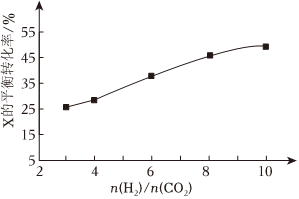
(4)催化劑和反應條件與反應物的轉化率和產物的選擇性高度相關。控制相同投料比和相同反應時間,得到如下四組實驗數據:
根據上表所給數據,用CO2生產甲醇的最優條件為實驗編號 溫度/K 催化劑 CO2的轉化率/% 甲醇的選擇性/% A 543 納米棒CuZnO12.3 42.3 B 543 納米片CuZnO11.9 72.7 C 553 納米棒CuZnO15.3 39.1 D 553 納米片CuZnO12.0 70.6 (填實驗編號)。
(5)一定條件下CO2能與N2發生反應:N2(g)+CO2(g)?C(s)+2NO(g)。某溫度下,若向2L體積恒定的密閉容器中充入等物質的量的N2和CO2,其中N2、NO物質的量隨時間變化的曲線如圖所示: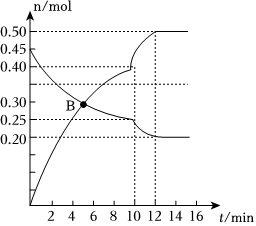
①圖中B點v正v逆(填“>”“<”或“=”)。
②第10min時,外界改變的條件可能是(填字母)。
A.加催化劑
B.增大C(s)的物質的量
C.減小CO2的物質的量
D.升溫
E.降溫組卷:20引用:1難度:0.5 -
 20.鐵及鐵的氧化物廣泛應用于生產、生活、航天、科研等領域,利用Fe2O3與CH4可制備“納米級”金屬鐵,回答下列問題:
20.鐵及鐵的氧化物廣泛應用于生產、生活、航天、科研等領域,利用Fe2O3與CH4可制備“納米級”金屬鐵,回答下列問題:
①3H2(g)+Fe2O3(s)?2Fe(s)+3H2O(g) ΔH1=-26.5kJ?mol-1
②CO2(g)+4H2(g)?CH4(g)+2H2O(g) ΔH2=-160kJ?mol-1
(1)恒溫恒容時,加入Fe2O3與CH4發生反應:3CH4(g)+4Fe2O3(s)?8Fe(s)+6H2O(g)+3CO2(g)。
①該反應的ΔH=。
②下列條件能判斷該反應達到平衡狀態的是。
a.消耗4molFe2O3的同時,消耗3molCO2
b.容器內氣體的顏色不再改變
c.容器內壓強不再改變
d.v正(CH4)=2v逆(H2O)
(2)在T℃下,向某密閉容器中加入3molCH4(g)和2molFe2O3(s)發生反應:3CH4(g)+4Fe2O3(s)?8Fe(s)+6H2O(l)+3CO2(g)。反應起始時壓強為p0,反應進行至10min時達到平衡狀態,測得此時容器中n(CH4):n(H2O)=1:1,10min內用Fe2O3(s)表示的平均反應速率為g?min-1;T℃下該反應的Kp=(用分壓表示,分壓=總壓×物質的量分數);T℃下若起始時向該容器中加入2molCH4(g)、4molFe2O3(s)、1molFe(s)、2molH2O(l)、2molCO2(g),則起始時v(正)v(逆)(填“>”“<”或“=”)。
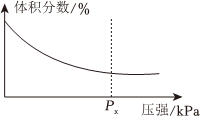
(3)一定溫度下,密閉容器中進行反應3CH4(g)+4Fe2O3(s)?8Fe(s)+6H2O(g)+3CO2(g),測得平衡時混合物中某氣體物質的體積分數隨壓強的變化如圖所示,則縱坐標表示的含碳物質是,隨著壓強增大,縱坐標的體積分數變化的原因是。組卷:22引用:3難度:0.7


