2021-2022學年陜西省安康市高二(下)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共16小題,每小題3分,共48分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.目前新冠病毒(COVID-19)正在全球蔓延,嚴重危害人類健康,日常生活中做好個人防護尤為重要!下列物質均可有效滅活新冠病毒,其有效成分屬于有機物的是( )
A.二氧化氯 B.75%酒精 C.過氧化氫 D.84消毒液 組卷:15引用:2難度:0.6 -
2.下列說法正確的是( )
A.2H2和3H2互為同位素 B.乙烯和乙烷互為同系物 C.NO2和N2O4互為同素異形體 D.正丁烷和異丁烷互為同分異構體 組卷:16引用:3難度:0.8 -
3.
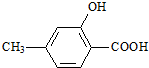 分子中不含有的基團是( )
分子中不含有的基團是( )A.甲基 B.羥基 C.羧基 D.醛基 組卷:96引用:4難度:0.9 -
4.己烷分子中含有14個氫原子,則己烷的分子式為( )
A.C4H14 B.C5H14 C.C6H14 D.C7H14 組卷:8引用:1難度:0.7 -
5.由乙烯推測丙烯的結構或性質,正確的是( )
A.分子中三個碳原子在同一直線上 B.分子中所有原子在同一平面上 C.與HCl加成只生成一種產物 D.能發生加聚反應 組卷:84引用:8難度:0.9 -
6.下列物質不能使酸性KMnO4溶液褪色的是( )
A.甲苯 B.乙烯 C.丙烷 D.氯化亞鐵 組卷:58引用:2難度:0.8 -
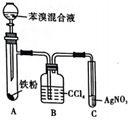 7.實驗室制備溴苯的反應裝置如圖所示,關于實驗操作或敘述錯誤的是( )
7.實驗室制備溴苯的反應裝置如圖所示,關于實驗操作或敘述錯誤的是( )A.反應物中的液溴不能換成溴水 B.裝置B的作用是吸收A中揮發的液溴等 C.實驗時裝置C中可觀察到有淡黃色沉淀產生 D.反應后的混合液經稀堿溶液洗滌、結晶,得到溴苯 組卷:72引用:1難度:0.8
二、非選擇題:共52分。
-
20.碲(Te)元素是當今新材料的主要成分之一。工業上從電解法精煉銅的陽極泥中提取純度較高的碲,經預處理后的陽極泥中含TeO2及鐵、鉛、銅的化合物等,通過以下流程得到:

已知:1.TeO2是兩性氧化物,微溶于水,可溶于強酸或強堿。
2.部分難溶物的Ksp如表:
回答下列問題:化合物 Fe(OH)2 Pb(OH)2 Cu(OH)2 FeS PbS CuS Ksp 8×10-16 1.2×10-15 1.3×10-20 4×10-19 1×10-28 6×10-36
(1)“堿浸”時TeO2發生反應的化學方程式為。
(2)加入Na2S溶液的主要目的是。
(3)“沉碲”發生反應的化學方程式為。
(4)“酸溶”后,將SO2通入溶液中進行“還原”得到粗碲,該反應的化學方程式是。
(5)電解法提純粗碲時,以Na2TeO3溶液為電解質溶液,陽極材料為。電解過程中陰極的電極反應式為。
(6)常溫下,向0.1mol/LNa2TeO3溶液中滴加鹽酸,當溶液pH=5時,溶液中c(TeO32-):c(H2TeO3)=。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)組卷:19引用:3難度:0.4 -
21.Ⅰ.甲醛在木材加工,醫藥等方面有重要用涂。甲醇直接脫氫是工業上合成甲醛的新方法,制備過程涉及的主要反應如下
反應Ⅰ:CH3OH(g)?HCHO(g)+H2(g) ΔH1=+85.2kJ?moI-1
反應Ⅱ:CH3OH(g)+O2(g)?HCHO(g)+H2O(g) ΔH212
反應Ⅲ:2H2(g)+O2(g)?2H2O(g) ΔH3=+483.6kJ?moI-1
(1)計算反應II的反應熱ΔH2=。
(2)750K下,在恒容密閉容器中,發生反應CH3OH(g)?HCHO(g)+H2(g),若起始壓強為p0,CH3OH平衡轉化率為a,則平衡時的總壓強p平=(用含p0和a的式子表示);當p0=100kPa,測得a=50.0%,計算反應平衡常數Kp=kPa(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數,忽略其它反應)
Ⅱ.CO2既是溫室氣體,也是重要的化工原料,以CO2為原料可合成多種有機物。
(3)CO2用于生產乙烯,已知2CO2(g)+6H2(g)?CH2=CH2(g)+4H2O(g)ΔH=QkJ?mol-1。一定條件下,按不同的投料比向某容積可變的恒壓密閉容器中充入CO2、H2,測得不同投料比時CO2的轉化率與溫度的關系如圖所示。X[X=n(H2)n(CO2)]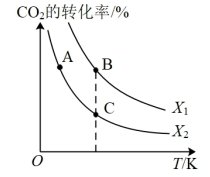
①X1X2(填“>”或“<”,后同),Q0。
②圖中A、B、C三點對應的平衡常數KA、KB、KC的大小關系為。組卷:10引用:1難度:0.3


