2022年北京市東城區高考化學二模試卷
發布:2024/4/20 14:35:0
一、選擇題(共14小題,每小題3分,滿分42分)
-
1.下列說法不正確的是( )
A.原子光譜可用于鑒定氫元素 B.電解法可用于冶煉鋁等活潑金屬 C.分餾法可用于提高石油中乙烯的產量 D.焰色試驗可用于區分NaCl和KCl 組卷:45引用:4難度:0.7 -
2.下列事實一定能說明CH3COOH是弱電解質的是( )
A.CH3COOH屬于有機化合物 B.CH3COOH能與乙醇發生酯化反應 C.用CH3COOH溶液做導電實驗,燈泡較暗 D.常溫下,0.1mol?L-1 CH3COOH溶液的pH約為3 組卷:89引用:3難度:0.7 -
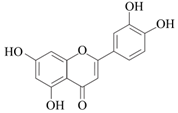 3.木犀草素有鎮咳化痰的作用,其結構簡式如圖。下列說法不正確的是( )
3.木犀草素有鎮咳化痰的作用,其結構簡式如圖。下列說法不正確的是( )A.分子中有3種含氧官能團 B.分子中碳原子均為sp2雜化 C.能與NaHCO3溶液反應,產生氣泡 D.能與Br2發生取代反應和加成反應 組卷:82引用:3難度:0.6 -
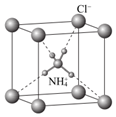 4.NH4Cl的晶胞為立方體,其結構如圖。下列說法不正確的是( )
4.NH4Cl的晶胞為立方體,其結構如圖。下列說法不正確的是( )A.NH4Cl晶體屬于離子晶體 B.NH4Cl晶胞中H—N—H鍵角為90° C.NH4Cl晶體中既有離子鍵又有共價鍵 D.每個Cl-周圍與它最近且等距離的 的數目為8NH+4組卷:270引用:14難度:0.8 -
5.下列離子檢驗利用了氧化還原反應的是( )
選項 待檢驗離子 檢驗試劑 A Fe3+ KSCN溶液 B I- Cl2、淀粉溶液 C SO42- 稀鹽酸、氯化鋇溶液 D NH4+ 濃NaOH溶液濕潤的紅色石蕊試紙 A.A B.B C.C D.D 組卷:180引用:6難度:0.7 -
6.下列解釋事實的方程式不正確的是( )
A.NO遇空氣變為紅棕色:2NO+O2═2NO2 B.用NaOH溶液吸收Cl2:OH-+Cl2═HClO+Cl- C.明礬凈水:Al3+3H2O?Al(OH)3(膠體)+3H+ D.向AgI懸濁液中滴加Na2S溶液,沉淀變黑:2AgI(s)+S2-(aq)═Ag2S(s)+2I-(aq) 組卷:53引用:3難度:0.7
二、解答題(共5小題,滿分58分)
-
18.Mn及其化合物在工業生產中具有重要的用途。
Ⅰ.以含MnCO3的礦石為原料,經硫酸溶解得到含Mn2+的溶液,再經一系列處理后進行電解,獲得金屬Mn。
(1)Mn在(填“陽極”或“陰極”)生成。
(2)陽極泥中含有MnO2,寫出產生MnO2的電極反應式:。
Ⅱ.陽極泥中除含錳元素外,還含有鉛元素,采用如圖方法可將它們分別轉化為活性MnO2和PbO。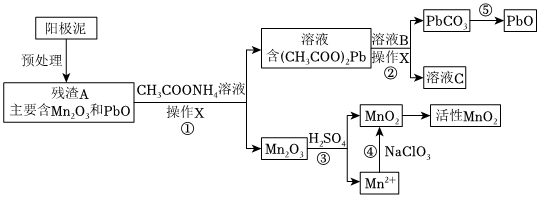
已知:(CH3COO)2Pb在水中難解離。
(3)操作X為。
(4)①中反應的離子方程式為。
(5)濾液C能循環使用,②中溶液B的溶質為。
(6)a.為了將③中Mn2O3完全轉化為MnO2,理論上④中加入的NaClO3與Mn2O3的物質的量之比為(已知NaClO3的還原產物為NaCl)。
b.加入NaClO3前,需將溶液pH調大至6左右。調節pH的目的是。
(7)活性MnO2純度的測定
i.用V1mLc1mol?L-1Na2C2O4溶液(H2SO4酸化)溶解wg活性MnO2樣品。(MnO2+C2+4H+═2CO2↑+Mn2++2H2O)O2-4
ii.用c2mol?L-1酸性KMnO4標準溶液滴定i中剩余的C2,消耗KMnO4,標準溶液V2mL(C2O2-4+2O2-4+16H+═2Mn2++10CO2↑+8H2O)。樣品中MnO2的質量分數=MnO-4[M(MnO2)=87g?mol-1]。組卷:88引用:4難度:0.5 -
19.實驗小組同學為探究Fe2+的性質,進行如下實驗。
[實驗Ⅰ]向2mL0.1mol?L-1FeSO4,溶液中滴加幾滴0.1mol?L-1KSCN溶液,無明顯現象,再滴加幾滴3% H2O2溶液(用H2SO4,酸化至pH=1),溶液顏色變紅。
(1)甲同學通過上述實驗分析Fe2+具有(填“氧化”或“還原“)性。
乙同學查閱資料發現Fe2+與SCN-也可發生反應,生成無色的配合物。為證實該性質,利用FeCO3進行如下實驗。
(2)FeCO3的制備:用過量NH4HCO3溶液與FeSO4溶液反應得到FeCO3,離子方程式為。
[實驗Ⅱ]驗證Fe2+與SCN-發生反應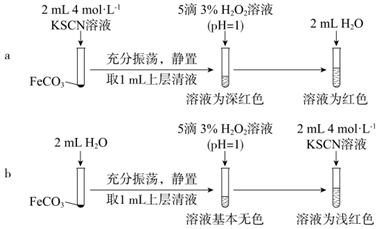
(3)通過實驗b排除了的干擾。
(4)從沉淀溶解平衡角度解釋實驗a和b最終溶液顏色不同的原因是。
丙同學設計實驗進一步證明Fe2+可與SCN-反應。
[實驗Ⅲ]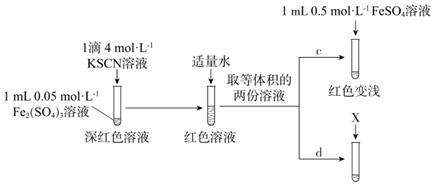
(5)上述實驗中,d為c的對照實驗。
①X為。
②實驗能夠證實Fe2+可與SCN-反應,則應觀察到的現象是。
(6)實驗III中若未加適量水稀釋,則無法通過現象得出結論。推測加水稀釋的目的可能有:使后續實驗顏色變化易于觀察;降低c(Fe3+),。組卷:133引用:3難度:0.6


