2016-2017學年陜西省延安市黃陵中學高二(上)開學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(每小題有1個選項符合題意,每小題2分,共60分)
-
1.為除去MgCl2酸性溶液中的Fe3+,可在加熱攪拌的條件下,加入一種試劑,過濾后再加入適量鹽酸,這試劑不可以是( )
A.NH3?H2O B.MgO C.Mg(OH)2 D.MgCO3 組卷:46引用:7難度:0.7 -
2.石灰乳中存在下列平衡:Ca(OH)2(s)?Ca2+(aq)+2OH- (aq),加入下列溶液,可使Ca(OH)2減少的是( )
A.Na2S溶液 B.AlCl3溶液 C.NaOH溶液 D.CaCl2溶液 組卷:22引用:1難度:0.9 -
3.向AgCl飽和溶液中加水,下列敘述正確的是( )
A.AgCl的溶解度增大 B.AgCl的溶解度、溶度積KSP均不變 C.AgCl的溶度積KSP增大 D.AgCl的溶解度、溶度積KSP均增大 組卷:20引用:4難度:0.7 -
4.在下列溶液中,BaSO4的溶解度最大的是( )
A.1 mol?L-1H2SO4溶液 B.2 mol?L-1H2SO4溶液 C.純水 D.0.1 mol?L-1H2SO4溶液 組卷:19引用:5難度:0.9 -
5.難溶電解質AB2飽和溶液中,c(A+)=xmol?L-1,c(B-)=ymol?L-1,則Ksp值為( )
A. 12xy2B.xy C.xy2 D.4xy2 組卷:29引用:4難度:0.7 -
6.AgCl和Ag2CrO4的溶度積分別為1.8×10-10 mol2?L-2和2.0×10-12 mol3?L-3,若用難溶鹽在溶液中的濃度來表示其溶解度,則下面的敘述中正確的是( )
A.AgCl和Ag2CrO4的溶解度相等 B.AgCl的溶解度大于Ag2CrO4的溶解度 C.兩者類型不同,不能由Ksp的大小直接判斷溶解能力的大小 D.都是難溶鹽,溶解度無意義 組卷:60引用:4難度:0.7 -
7.下列說法正確的是( )
A.在一定溫度下的AgCl水溶液中,Ag+和Cl-濃度的乘積是一個常數 B.AgCl的Ksp=1.8×10-10 mol2?L-2,在任何含AgCl固體的溶液中,c(Ag+)=c(Cl-)且Ag+與Cl-濃度的乘積等于1.8×10-10 mol2?L-2 C.溫度一定時,當溶液中Ag+和Cl-濃度的乘積等于Ksp值時,此溶液為 AgCl的飽和溶液 D.向飽和AgCl水溶液中加入少量鹽酸,Ksp值變大 組卷:75引用:14難度:0.7 -
8.下列敘述中,正確的是( )
A.溶度積大的化合物溶解度肯定大 B.向含有AgCl固體的溶液中加入適量的水使溶解又達到平衡時,AgCl的溶度積不變,其溶解度也不變 C.將難溶電解質放入水中,溶解達到平衡時,電解質離子的濃度的乘積就是該物質的溶度積 D.AgCl水溶液的導電性很弱,所以AgCl為弱電解質 組卷:40引用:4難度:0.9 -
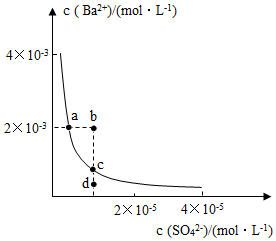 9.某溫度時,BaSO4在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是( )
9.某溫度時,BaSO4在水中的沉淀溶解平衡曲線如圖所示。下列說法正確的是( )
提示BaSO4(s)?Ba2+(aq)+SO42-(aq)的平衡常數Ksp=[Ba2+]?[SO42-],稱為溶度積常數。A.加入Na2SO4可以使溶液由a點變到b點 B.通過蒸發可以使溶液由d點變到c點 C.d點無BaSO4沉淀生成 D.a點對應的Ksp大于c點對應的Ksp 組卷:639引用:24難度:0.7 -
10.對于難溶鹽MX,其飽和溶液中的M+和X-的物質的量濃度之間的關系近似于:c(H+)?c(OH-)=KW,存在著c(M+)?c(X-)=Ksp的關系.現將足量AgCl固體分別放入下列物質中,AgCl溶解度由大到小的排列順序為( )
①20mL 0.01mol?L-1KCl溶液
②30mL 0.02mol?L-1CaCl2溶液
③40mL 0.03mol?L-1HCl溶液
④10mL蒸餾水
⑤50mL 0.05mol?L-1AgNO3.A.①>②>③>④>⑤ B.④>①>③>②>⑤ C.⑤>④>②>①>③ D.④>③>⑤>②>① 組卷:119引用:17難度:0.7 -
11.下列化學原理的應用,主要用沉淀溶解平衡原理來解釋的是( )
①熱純堿溶液的洗滌油污能力強;
②誤將鋇鹽[BaCl2、Ba(NO3)2]當作食鹽食用時,常用0.5%的Na2SO4溶液解毒;
③溶洞、珊瑚的形成;
④碳酸鋇不能做“鋇餐”而硫酸鋇則能;
⑤泡沫滅火器滅火的原理.A.②③④ B.①②③ C.③④⑤ D.①②③④⑤ 組卷:305引用:24難度:0.9
二、填空題(共4小題,共40分)
-
33.已知難溶電解質在水溶液中存在溶解平衡:
MmAn(s)═mMn+(aq)+nAm-(aq)
Ksp=cm(Mn+)?cn(Am-),稱為溶度積。
某學習小組欲探究CaSO4沉淀轉化為CaCO3沉淀的可能性,查得如下資料:(25℃)
實驗步驟如下:難溶電解質 CaCO3 CaSO4 MgCO3 Mg(OH)2 Ksp 2.8×10-9 9.1×10-6 6.8×10-6 1.8×10-11
①往100mL 0.1mol?L-1的CaCl2溶液中加入100mL 0.1mol?L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述懸濁液中加入固體Na2CO3 3g,攪拌,靜置,沉淀后棄去上層清液。
③再加入蒸餾水攪拌,靜置,沉淀后再棄去上層清液。
④_______。
(1)由題中信息Ksp越大,表示電解質的溶解度越(填“大”或“小”)。
(2)寫出第②步發生反應的化學方程式:。
(3)設計第③步的目的是。
(4)請補充第④步操作及發生的現象:。組卷:83引用:4難度:0.5 -
34.醫學上在進行胃腸疾病的檢查時,利用X射線對BaSO4穿透能力較差的特性,常用BaSO4做內服造影劑,這種檢查手段稱為鋇餐透視.
Ⅰ.請寫出BaSO4能作為鋇餐透視的另外一個理由:.
Ⅱ.請用文字敘述和離子方程式說明鋇餐透視時為什么不用BaCO3?.
Ⅲ.某課外活動小組為探究BaSO4的溶解度,分別將足量BaSO4放入:
①5mL水
②20mL 0.5mol?L-1的Na2SO4溶液
③40mL 0.2mol?L-1的Ba(OH)2溶液
④40mL 0.1mol?L-1的H2SO4溶液中,溶解至飽和.
(1)以上各溶液中,c(Ba2+)的大小順序正確的是,BaSO4的溶解度的大小順序為(填序號).
A.③>①>④>②B.③>①>②>④
C.①>④>③>②D.①>③>④>②
(2)已知25℃時,Ksp(BaSO4)=1.1×10-10,上述條件下,溶液③中的c()為SO2-4,溶液②中c(Ba2+)為.
(3)某同學取同樣的溶液③和溶液④直接混合,則混合溶液的pH為(假設混合后溶液的體積為混合前兩溶液的體積之和).組卷:42引用:1難度:0.5


