當前位置:
章節挑題
請展開查看知識點列表
>
更多>>
 已完結
已完結
|
期末復習
典型試卷
考前必刷
瀏覽次數:853
更新:2025年06月03日
|
 已完結
已完結
|
熱點預測
高考復習
難題搶練
瀏覽次數:1135
更新:2025年05月26日
|
301.CFCl3破壞臭氧層的過程如圖所示,下列說法錯誤的是( )
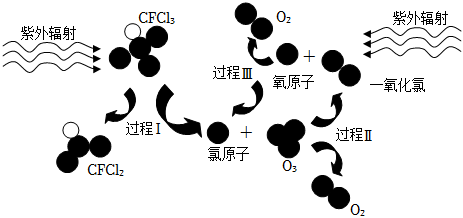
A.過程Ⅰ:斷裂C-Cl鍵 B.過程Ⅱ:O3+Cl═ClO+O2 C.過程Ⅲ:發生了O2═O+O反應 D.整個過程中氯原子是破壞臭氧層的催化劑 發布:2024/5/23 20:38:36組卷:200引用:3難度:0.7302.下列有關元素周期表和元素周期律的說法,錯誤的是( )
①元素周期表中s區、d區和ds區的元素都是金屬元素
②d區元素最后一個核外電子一定填充在s能級上
③原子核外電子的能層越多,原子半徑越大
④同一周期自左至右,元素的第一電離能依次增大.A.只有①②③ B.只有②③ C.只有③④ D.①②③④ 發布:2024/5/23 20:38:36組卷:57引用:8難度:0.7303.設NA表示阿伏加德羅常數的值,則下列說法正確的是( )
A.1molNH3分子中含有3NA個σ鍵和4NA個sp3雜化軌道 B.1molCO2分子中含有2NA個σ鍵和2NA個sp2雜化軌道 C.1molC2H2分子中含有3NA個σ鍵、2NA個π鍵 D.1molC2H4分子中含有4NA個σ鍵、2NA個π鍵 發布:2024/5/23 20:38:36組卷:1引用:2難度:0.8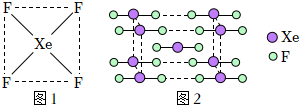 304.氟是人體內重要的微量元素之一,氟化物廣泛分布于自然界。XeF4的結構示意圖(圖1)和XeF2晶胞結構圖(圖2),下列說法正確的是( )
304.氟是人體內重要的微量元素之一,氟化物廣泛分布于自然界。XeF4的結構示意圖(圖1)和XeF2晶胞結構圖(圖2),下列說法正確的是( )A.F2分子中存在p-po鍵,HF分子中存在s-po鍵 B.XeF4分子間以氫鍵結合形成分子晶體 C.XeF4是一種極性分子 D.1個XeF2晶胞中實際擁有7個XeF2分子 發布:2024/5/23 20:38:36組卷:5引用:2難度:0.7305.對Na、Mg、Al的有關性質的敘述正確的是( )
A.堿性:NaOH<Mg(OH)2<Al(OH)3 B.第一電離能:Na<Mg<Al C.電負性:Na>Mg>Al D.還原性:Na>Mg>Al 發布:2024/5/23 20:38:36組卷:93引用:71難度:0.7306.Cu3N具有良好的電學和光學性能,在電子工業領域、航空航天領域、國防領域、通訊領域以及光學工業等領域中,發揮著廣泛的、不可替代的巨大作用。
(1)Cu在周期表中的位置為,Cu原子的基態價層電子排布式為;NF3的分子空間結構是。類比NH3?H2О表示出代表性分子NH4F含有的氫鍵。
(2)Cu3N在酸性溶液中不穩定,可發生歧化反應生成Cu2+和Cu,其反應的離子方程式:。
(3)已知:CuO在高溫下會分解成Cu2O,試從洪特規則角度解釋其原因:。
(4)在Cu的催化作用下,乙醇可被空氣氧化為乙醛(CH3CHO),乙醛分子中H-C=O的鍵角(填“大于”“等于”或“小于”)乙醇分子中的H-C-O的鍵角。發布:2024/5/23 20:38:36組卷:1引用:2難度:0.6 307.如圖為元素周期表中短周期的一部分,關于Y、Z、M的說法正確的是( )
307.如圖為元素周期表中短周期的一部分,關于Y、Z、M的說法正確的是( )A.電負性:Y>Z>M B.離子半徑:M->Z2->Y- C.ZM2分子中各原子的最外層均滿足8電子穩定結構 D.Z元素基態原子最外層電子的軌道表示式為 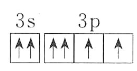 發布:2024/5/23 20:38:36組卷:12引用:2難度:0.7
發布:2024/5/23 20:38:36組卷:12引用:2難度:0.7308.W、X、Y、Z、N是短周期元素,它們的核電荷數依次增大。
(1)W單質的化學式為元素 元素性質或原子結構 W 原子核內無中子 X 原子核外s能級上的電子總數與p能級上的電子總數相等 Y Y原子半徑在該周期中最大該周期中最大 Z 原子核外p能級上的電子總數比s能級上的電子總數多2 N 最外層電子數比次外層電子數少1 ,Z元素原子核外有個原子軌道填充了電子。
(2)Y、Z和N三種元素第一電離能由大到小的順序為(填元素符號)。
(3)X與Z兩元素的電負性較大的是(填元素符號)。
(4)Z元素原子共有種不同運動狀態的電子。發布:2024/5/23 20:38:36組卷:38引用:4難度:0.6309.現有四種元素的基態原子的電子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5。則下列有關說法中正確的是( )
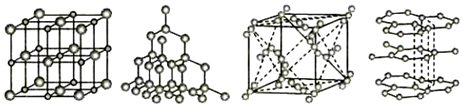
A.核電荷數最大的是③ B.原子半徑最大的是① C.電負性最小的是③ D.最外層電子數最多的是④ 發布:2024/5/23 20:38:36組卷:32引用:2難度:0.9310.如圖分別代表NaCl、金剛石、干冰、石墨結構的一部分。下列說法正確的是( )
A.NaCl晶體只有在熔融狀態下離子鍵被完全破壞,才能形成自由移動的離子 B.金剛石中存在的化學鍵只有共價鍵,不能導電 C.干冰中的化學鍵只需吸收很少的熱量就可以破壞,所以干冰容易升華 D.石墨中碳原子的最外層電子都參與了共價鍵的形成,故熔點很高、硬度很大 發布:2024/5/23 20:38:36組卷:0引用:2難度:0.6



