當前位置:
章節挑題
請展開查看知識點列表
>
更多>>
 已完結
已完結
|
期末復習
典型試卷
考前必刷
瀏覽次數:853
更新:2025年06月03日
|
 已完結
已完結
|
熱點預測
高考復習
難題搶練
瀏覽次數:1135
更新:2025年05月26日
|
291.“碘伏”又叫“聚維酮碘溶液”。聚維酮通過氫鍵與HI3形成聚維酮碘,其結構表示如下:
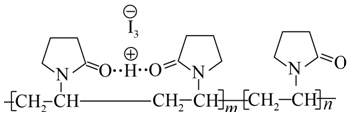
(圖中虛線表示氫鍵)。下列說法正確的( )A.C、N、O原子的電負性依次增大 B.聚維酮碘中含有離子鍵、共價鍵、氫鍵等化學鍵 C.聚維酮易溶于水的原因是與水分子間形成氫鍵 D.分子中的含N五元環一定是平面結構 發布:2024/5/23 20:38:36組卷:84引用:5難度:0.7292.下列說法正確的是( )
A.氫原子的電子云圖中小黑點的疏密表示電子在核外單位體積內出現機會的多少 B.最外層電子數為ns2的元素都在元素周期表第2列 C.處于最低能量的原子叫做基態原子,1s22s22px1→1s22s22py1過程中形成的是發射光譜 D.已知某元素+3價離子的電子排布式為1s22s22p63s23p63d5,該元素位于周期表中的第四周期第VIII族位置,屬于ds區 發布:2024/5/23 20:38:36組卷:45引用:4難度:0.6293.下列說法中正確的是( )
A.[Ne]3s2表示的是Mg原子 B.3p2表示第三能層有2個電子 C.同一原子中,1s、2s、3s電子的能量逐漸減小 D.2p、3p、4p能級容納的最多電子數依次增多 發布:2024/5/23 20:38:36組卷:63引用:5難度:0.5294.(1)肼(N2H4)分子可視為NH3分子中的一個氫原子被-NH2(氨基)取代形成的另一種氮的氫化物。
①NH3分子的空間結構是;N2H4分子中氮原子軌道的雜化類型是。
②肼可用作火箭燃料,燃燒時發生的反應:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)ΔH=-1038.7kJ?mol-1若該反應中有4molN-H鍵斷裂,則形成的π鍵有mol。
(2)H2Se的酸性比H2S(填“強”或“弱”)。氣態SeO3分子的空間結構為,SO32-的空間結構為。發布:2024/5/23 20:38:36組卷:8引用:1難度:0.6295.下列現象與氫鍵有關的是( )
①NH3的熔、沸點比VA族其他元素氫化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液態水的密度小
④水分子高溫下也很穩定.A.①②③④ B.①②③ C.①②④ D.②③④ 發布:2024/5/23 20:38:36組卷:76引用:4難度:0.5296.碳和硅是自然界中大量存在的元素,硅及其化合物是工業上最重要的材料。粗硅的制備有二種方法:
方法一:SiO2+2CSi+2CO↑ 方法二:SiO2+2Mg高溫Si+2MgO高溫
(1)基態硅原子中存在對自旋相反的電子,基態Mg 的最外層電子所占據的能級的電子云能廓圖是。
(2)上述反應中所有元素第一電離能最小的元素是(填元素符號)。
(3)試比較C (金剛石),晶體Si,CO 三種物質的熔沸點從高到低的順序,試解釋原因:。
(4)CO 在配合物中可作為配體,在Cr(CO)6配合物中配原子是(填元素符號)1mol該配合物中含有π鍵的數目。
(5)SiO2晶跑(如圖1)可理解成將金剛石晶胞(如圖2)中的C原子置換成Si原子,然后在Si-Si之間插入O原子而形成。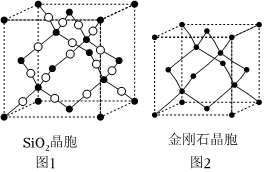
①推測SiO2晶胞中Si采用雜化,O-Si-O的鍵角。
②SiO2晶跑中,含有Si原子個和O原子個。
③假設金剛石晶胞的邊長為apm,試計算該晶胞的密度g/cm3 (寫出表達式即可)。發布:2024/5/23 20:38:36組卷:20引用:5難度:0.4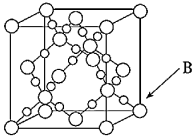 297.我國從國外進口某原料經測定主要含有A、B、C、D、E五種前四周期元素,且原子序數依次增大.元素A、B、C、D、E的原子結構等信息如下:
297.我國從國外進口某原料經測定主要含有A、B、C、D、E五種前四周期元素,且原子序數依次增大.元素A、B、C、D、E的原子結構等信息如下:
請回答下列問題:(用A、B、C、D、E,所對應的元素符號作答)元素 元素性質或原子結構 A 周期表中原子半徑最小的元素 B 原子核外有三種不同的能級且各個能級所填充的電子數相同 C 最外層P軌道半充滿 D 位于短周期,其原子的核外成對電子數是未成對電子數的3倍 E 位于ds區且原子的最外層電子數與A的相同
(1)B、C、D第一電離能由大到小為.
(2)E的二價離子的電子排布式為.
(3)A2B2D4常用作除銹劑,該分子中B的雜化方式為;1molA2B2D4分子中含有σ鍵數目為.
(4)與化合物BD互為等電子體的陰離子化學式為;
(5)B2A6、C2A4分子中均含有18個電子,它們的沸點相差較大,主要原因是.
(6)BD2在高溫高壓下所形成晶體的晶胞如圖所示,一個該晶胞中含個D原子.發布:2024/5/23 20:38:36組卷:46引用:6難度:0.3298.下列敘述正確的是( )
A.鹵化氫分子中,鹵素的非金屬性越強,共價鍵的極性越大 B.以極性鍵結合的分子一定是極性分子 C.判斷A2B或AB2型分子是否是極性分子的依據是看分子中是否含有極性鍵 D.非極性分子中,各原子間都應以非極性鍵結合 發布:2024/5/23 20:38:36組卷:14引用:5難度:0.7299.元素X 位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為2.元素Y基態原子的3p 軌道上有4個電子.元素Z 的原子最外層電子數是其內層的3倍.
(1)在Y的氫化物(H2Y)分子中,Y原子軌道的雜化類型是.
(2)Z的氫化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是.
(3)Y 與Z 可形成YZ42-
①YZ42-的空間構型為(用文字描述).
②寫出一種由第三周期元素組成的與YZ42-互為等電子體的分子的化學式:.
(4)X的氯化物與氨水反應可形成配合物[X(NH3)4]Cl2,1mol該配合物中含有σ鍵的數目為.發布:2024/5/23 20:38:36組卷:12引用:2難度:0.5300.下圖是從NaCl或CsCl晶體結構圖中分割出來的部分結構圖,其中屬于從NaCl晶體中分割出來的結構圖是( )

A.圖(1)和圖(3) B.圖(2)和圖(3) C.圖(1)和圖(4) D.只有圖(4) 發布:2024/5/23 20:38:36組卷:170引用:18難度:0.7



