當前位置:
章節挑題
請展開查看知識點列表
>
更多>>
 已完結
已完結
|
期末復習
典型試卷
考前必刷
瀏覽次數:853
更新:2025年06月03日
|
 已完結
已完結
|
熱點預測
高考復習
難題搶練
瀏覽次數:1135
更新:2025年05月26日
|
281.已知1~18號元素的離子aW3+、bX+、cY2-、dZ-具有相同的電子層結構,下列關系正確的是( )
A.質子數:c>d B.離子的還原性:Y2->Z- C.離子半徑:X+>Z- D.原子半徑:X<W 發布:2024/5/23 20:38:36組卷:64引用:2難度:0.8282.(1)有①
O、168O、178O ②H2、D2、T2 ③石墨、金剛石 ④188H、11H、21H四組微粒或物質.互為同位素的是31(填編號).
(2)下列物質中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O 只存在共價鍵的是;屬于離子化合物,但含有共價鍵的是.
(3)用電子式表示下列物質:
MgCl2N2NH+4Na2O2.發布:2024/5/23 20:38:36組卷:172引用:4難度:0.5283.某同學為探究元素周期表中元素性質的遞變規律,設計了如下系列實驗:
Ⅰ.探究同周期元素性質的遞變規律
(1)相同條件下,將鈉、鎂、鋁各1 mol分別投入到足量的同濃度的稀鹽酸中,試預測實驗結果:與稀鹽酸反應最劇烈;與稀鹽酸反應產生的氣體最多。
(2)向Na2SiO3溶液中加入稀H2SO4出現白色沉淀,可證明S的非金屬性比Si強,反應的離子方程式為。
Ⅱ.探究同主族元素非金屬性的遞變規律
某研究性學習小組設計了一組實驗來探究ⅦA族元素原子的得電子能力強弱規律。圖中A、B、C是三個可供選擇制取氯氣的裝置,裝置D的玻璃管中①、②處依次放置蘸有NaBr溶液、NaOH濃溶液的棉球。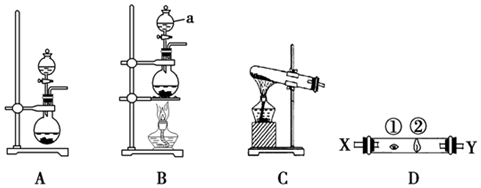
(3)寫出裝置B中儀器a的名稱。
(4)實驗室制取氯氣還可采用如下原理:2KMnO4+16HCl(濃)═2KCl+2MnCl2+5Cl2↑+8H2O,依據該反應原理選擇(填“A”或“B”或“C”)裝置制取氯氣。
(5)反應裝置的導氣管連接裝置D的X導管,①處發生反應的離子方程式為:。②處發生反應的離子方程式為:。發布:2024/5/23 20:38:36組卷:85引用:4難度:0.7284.NF3可由NH3和F2在Cu催化劑存在下反應直接得到:4NH3+3F2
NF3+3NH4F,化學方程式中的5種物質所屬的晶體類型沒有涉及的是( )CuA.離子晶體 B.分子晶體 C.共價晶體 D.金屬晶體 發布:2024/5/23 20:38:36組卷:23引用:5難度:0.7285.下列敘述中正確的是( )
A.VSEPR模型就是分子的空間構型 B.在共價化合物分子中一定存在σ鍵 C.全由非金屬元素組成的化合物一定是共價化合物 D.共價鍵鍵長越短,鍵能一定越大 發布:2024/5/23 20:38:36組卷:60引用:5難度:0.9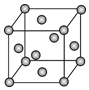 286.已知鉬(Mo)的晶胞如圖所示,鉬原子半徑為apm,相對原子質量為M,以NA表示阿伏加德羅常數的值。
286.已知鉬(Mo)的晶胞如圖所示,鉬原子半徑為apm,相對原子質量為M,以NA表示阿伏加德羅常數的值。
(1)鉬晶體的堆積方式為,晶體中粒子的配位數為。
(2)構成鉬晶體的粒子是(填“原子”,“分子”或“離子”),晶胞中所含的該種粒子數為。
(3)金屬鉬的密度為g?cm-3。發布:2024/5/23 20:38:36組卷:23引用:2難度:0.8287.某物質的晶體內部一個截面上原子的排布情況如圖所示,則該晶體的化學式可表示為( )
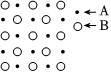
A.A2B B.AB C.AB2 D.A3B 發布:2024/5/23 20:38:36組卷:109引用:11難度:0.9288.下列有關說法不正確的是( )
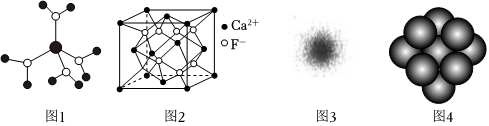
A.水合銅離子的模型如圖1所示,1個水合銅離子中有4個配位鍵 B.CaF2晶體的晶胞如圖2所示,每個CaF2晶胞平均占有4個Ca2+ C.H原子的電子云如圖3所示,H原子核外的大多數電子在原子核附近運動 D.金屬Cu原子堆積模型如圖4所示,該金屬晶體為最密堆積,每個Cu原子的配位數均為12 發布:2024/5/23 20:38:36組卷:3引用:3難度:0.6289.下列有關化學鍵、氫鍵和范德華力的敘述中,不正確的是( )
A.金屬鍵是金屬陽離子與“電子氣”之間的較強作用,金屬鍵無方向性和飽和性 B.共價鍵是原子之間通過共用電子對形成的化學鍵,共價鍵有方向性和飽和性 C.范德華力是分子間存在的一種作用力,分子的極性越大,范德華力越大 D.氫鍵不是化學鍵而是分子間的一種作用力,所以氫鍵只存在于分子與分子之間 發布:2024/5/23 20:38:36組卷:113引用:10難度:0.9290.生物固氮與模擬生物固氮都是重大基礎性研究課題。大連理工大學曲景平教授團隊設計合成了一類新型鄰苯二硫酚橋聯雙核鐵配合物,建立了雙鐵分子仿生化學固氮新的功能分子模型。如圖是所發論文插圖。以下說法錯誤的是( )
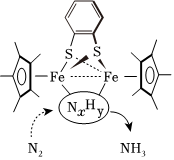
A.催化劑不能改變反應的焓變 B.催化劑不能改變反應的活化能 C.圖中反應中間體NXHY數值Y:X<3 D.圖示催化劑分子中包含配位鍵 發布:2024/5/23 20:38:36組卷:67引用:3難度:0.6



