當前位置:
章節挑題
請展開查看知識點列表
>
更多>>
|
原創
 更新中
更新中
|
知識圖解
新知探究
答疑解惑
針對訓練
瀏覽次數:37
更新:2025年06月13日
|
 更新中
更新中
|
中考模擬
分類匯編
專項突破
瀏覽次數:2156
更新:2025年06月10日
|
891.下面金屬的用途利用金屬什么性質。
(1)鐵做鐵鍋:(2)銅做導線:
(3)鎢做燈絲:(4)金做首飾:。發布:2024/6/27 10:35:59組卷:16引用:3難度:0.5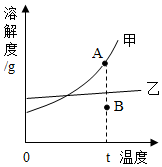 892.如圖是甲、乙兩種固體物質的溶解度曲線,請回答下列問題:
892.如圖是甲、乙兩種固體物質的溶解度曲線,請回答下列問題:
(1)t℃時,甲物質的溶解度(選填“>”、“<”或“=”)乙物質的溶解度。
(2)若乙中混有少量甲物質,提純乙常采用的方法是(選填“降溫結晶”或“蒸發結晶”)。
(3)欲使甲溶液的狀態從A點轉化到B點,可采用的措施(填一種即可)。發布:2024/6/27 10:35:59組卷:152引用:3難度:0.5893.現有硫酸鈉和氯化鈉的固體混合物30g,加316.6g水使之全部溶解,將300g氯化鋇溶液分三次加入該溶液中,實驗數據記錄如表:
(1)表中m的數值是第1次 第2次 第3次 加入氯化鋇溶液質量/g 100 100 100 生成沉淀的質量/g 23.3 m 46.6 。
(2)原固體混合物中硫酸鈉的質量分數是多少?(計算結 果精確到0.1%)
(3)恰好完全反應時,所得溶液中溶質的質量分數為多少?發布:2024/6/27 10:35:59組卷:294引用:5難度:0.2894.13g鋅與100g稀硫酸恰好完全反應,求:
(1)稀硫酸中溶質的質量分數。
(2)反應后所得溶液中溶質的質量分數。發布:2024/6/27 10:35:59組卷:34引用:12難度:0.5895.實驗室欲配制一定質量分數的食鹽溶液.如圖是實驗操作過程示意圖,請回答:
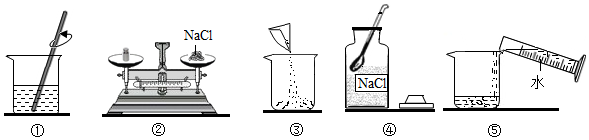
(1)如圖中一處錯誤的操作是(填序號),改正操作后,用上述圖示的序號表示配制溶液的正確操作順序.
(2)圖①中玻璃棒攪拌的目的是什么?
(3)若所配制溶液的溶質質量分數偏小,請寫出造成誤差的一點原因.發布:2024/6/27 10:35:59組卷:19引用:3難度:0.5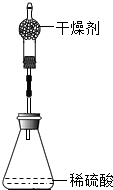 896.為測定鋅銅合金中鋅的含量,取該合金放入如圖 盛有稀硫酸的錐形瓶中,發生反應:Zn+H2SO4=ZnSO4+H2↑.多次實驗后,取平均值所得數據如下表:
896.為測定鋅銅合金中鋅的含量,取該合金放入如圖 盛有稀硫酸的錐形瓶中,發生反應:Zn+H2SO4=ZnSO4+H2↑.多次實驗后,取平均值所得數據如下表:
若不考慮干燥劑吸收空氣中的水蒸氣,計算:反應前 充分反應后裝置及反應剩余物質質量 裝置和足量的稀硫酸質量 鋅銅合金質量 342.10g 16.00g 357.70g
(1)根據質量守恒定律求生成氫氣的質量。
(2)該合金中鋅的質量分數。發布:2024/6/27 10:35:59組卷:492引用:59難度:0.3897.用25克含雜質 20%的大理石與100克的稀鹽酸恰好反應,問:
(1)一共生成多少克二氧化碳?
(2)鹽酸溶液的溶質質量分數?
(3)反應后溶液的溶質質量分數?發布:2024/6/27 10:35:59組卷:11引用:1難度:0.6898.某化學小組在實驗室里準備配制溶質質量分數一定的氯化鈉溶液。如圖是實驗操作過程示意圖:
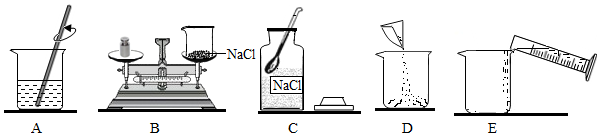
(1)用上述圖示的序號表示正確配制溶液的操作順序為(填序號)。
(2)計算:實驗室要配制100g質量分數為6%的氯化鈉溶液。氯化鈉的質量為g。
(3)稱量:稱量前進行的操作為,用托盤天平稱量所需的氯化鈉,請改正一處錯誤為。
(4)量取:用量筒來量取所需的水(水的密度為1g/cm3),量筒的規格是(從下列中選用:“10mL”、“50mL”或“100mL”)。量取液體時,量筒必須放平,視線與液體的保持水平。
(5)溶解,裝瓶并貼標簽:溶解氯化鈉需要用到的玻璃儀器有玻璃棒和,其中玻璃棒在該實驗中所起的作用是。
(6)實驗室要配制一定溶質質量分數的溶液,可能是某些原因導致所配溶液的溶質質量分數偏低,請你分析可能原因有哪些?(至少說明兩點)。發布:2024/6/27 10:35:59組卷:30引用:1難度:0.5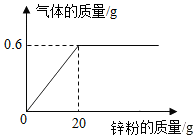 899.向147克稀硫酸中加入鋅粉(僅含不溶于酸的雜質),所加鋅粉的質量與產生氣體的質量關系如圖所示。求:
899.向147克稀硫酸中加入鋅粉(僅含不溶于酸的雜質),所加鋅粉的質量與產生氣體的質量關系如圖所示。求:
(1)此過程中產生氣體的最大質量是g。
(2)原稀硫酸中溶質的質量分數。(寫出計算過程)發布:2024/6/27 10:35:59組卷:157引用:5難度:0.1900.為探究CO2與NaOH溶液發生的反應,某興趣小組嘗試用不同的方式進行實驗。
【查閱資料】Ⅰ.20℃時,幾種物質在水中的溶解度見下表:
Ⅱ.本實驗條件下,Na2CO3溶液和NaHCO3溶液的pH分別約為11.0和8.5。物質 Na2CO3 NaHCO3 Ca(OH)2 Ba(OH)2 溶解度/g 21.5 9.6 0.165 3.89
【實驗探究】
(1)實驗一:小雨取一充滿CO2的礦泉水瓶,加入一定量的水,立即擰緊瓶蓋,振蕩,發現瓶子 變癟,小雨另取一相同的充滿CO2的礦泉水瓶,向其中加入與水等體積的NaOH溶液,立即擰緊瓶蓋,振蕩,得到溶液X,此時觀察到的現象是,實驗中,小雨采用兩只礦泉水瓶做對比實驗的目的是。
(2)實驗二:為檢驗CO2與NaOH溶液反應的產物,小亮取實驗一所得溶液X少許,向其中滴加BaCl2溶液,有白色沉淀產生,該反應的化學方程式為,實驗中不宜將BaCl2溶液換成CaCl2溶液的原因是。
(3)實驗三:小華取實驗一所得溶液X少許,向其中加入過量的BaCl2溶液,振蕩,靜置,取上層清液,滴入1滴酚酞試液,發現溶液呈色,證明溶液X中有NaOH剩余。實驗中,小華沒有直接向少量溶液X中滴入酚酞試液,理由是。
(4)實驗四:興趣小組將CO2持續通入一定濃度一定量的NaOH溶液中,用數字化實驗技術測定反應過程中溶液的pH和溫度變化,結果如圖 1、圖 2 所示。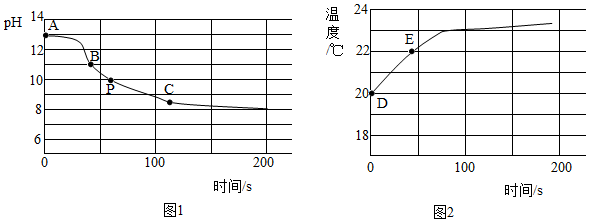
圖1中:AB 段發生反應的化學方程式為。BC段發生反應的化學方程式為。P點時的溶液中的溶質為(寫化學式)。圖2中,DE段溫度變化的原因是。發布:2024/6/27 10:35:59組卷:60引用:1難度:0.4



