當前位置:
章節挑題
請展開查看知識點列表
>
更多>>
 已完結
已完結
|
期末復習
專項訓練
能力提升
瀏覽次數:17
更新:2025年05月29日
|
|
原創
 更新中
更新中
|
科學規劃
每日突破
終極押題
實戰演練
瀏覽次數:1751
更新:2025年05月28日
|
2871.下列有關空氣的說法不正確的是( )
A.氮氣常用作保護氣 B.空氣中的氧氣約占空氣總體積的五分之一 C.空氣中的稀有氣體可制成多種用途的電光源 D.空氣中的氧氣能支持燃燒,可作燃料 發布:2024/7/28 8:0:9組卷:155引用:5難度:0.92872.實驗室中常用氯酸鉀受熱分解制取氧氣。
(1)寫出該反應的文字表達式
(2)寫出下列儀器的名稱:a; h;
(3)為組裝用氯酸鉀制氧發生裝置,請你從如圖1中選擇所需的儀器(填序號,下同)。裝藥品前應首先進行
(4)用排水法收集氧氣完畢后,應先撤離導管后熄滅酒精燈,原因是
(5)實驗室里還可采用如圖2裝置,通過分解過氧化氫(H2O2)的方法制取氧氣。寫出該反應的反應的文字表達式:此裝置中錐形瓶可用圖1中的哪些儀器替代(任選一種用序號填空)收集氧氣的方法還可以用法。
(6)通過查閱資料得知:氨氣(NH3)是一種密度比空氣小且極易溶于水的氣體,其水溶液稱為氨水。小楓同學用加熱氯化銨和氫氧化鈣的固體混合物來制取氨氣,他應選擇的發生裝置(如圖3)是,收集裝置是 發布:2024/7/28 8:0:9組卷:6引用:2難度:0.5
發布:2024/7/28 8:0:9組卷:6引用:2難度:0.5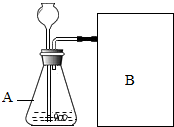 2873.實驗室為了快速制取氧氣,某化學興趣小組對過氧化氫溶液制取氧氣的實驗探究如下:
2873.實驗室為了快速制取氧氣,某化學興趣小組對過氧化氫溶液制取氧氣的實驗探究如下:
【提出問題】過氧化氫溶液生成氧氣的快慢與什么因素有關?
【作出假設】過氧化氫溶液生成氧氣的快慢與催化劑種類有關。
【設計實驗】常溫下,在兩瓶相同體積相同濃度的過氧化氫溶液中分別加入相同質量的二氧化錳和紅磚粉,測量各生成一瓶(相同體積)氧氣所需要的時間,也可通過比較反應快慢。
【進行實驗】如圖是他們進行實驗的裝置圖,此實驗中B處收集氧氣宜采用的方法是。
【實驗記錄】
【解釋結論】該探究過程得出的結論是實驗編號 1 2 反應物 5mL6%過氧化氫溶液 5mL6%過氧化氫溶液 催化劑 1g紅磚粉 1g二氧化錳 時間 153s 32s 。
【反思評價】過氧化氫溶液在常溫下分解較緩慢,加入二氧化錳或紅磚粉后反應明顯加快,若要證明二氧化錳或紅磚粉是否為該反應的催化劑,還需要增加實驗來驗證它們在化學反應前后的是否改變。
【表達交流】寫出實驗室用過氧化氫制取氧氣的文字表達式:。發布:2024/7/28 8:0:9組卷:49引用:5難度:0.52874.空氣中氧氣含量測定的經典賞析。
教材中介紹了拉瓦錫用定量的方法研究了空氣的成分(實驗裝置如圖)。
(1)寫出汞與氧氣反應的文字表達式:。
(2)本實驗中選擇使用汞的優點有:
①汞在加熱的條件下,只和氧氣反應。
②汞為液態,在汞槽中起到液封的作用,并能直接用來測量反應器內空氣體積的變化。
③生成的氧化汞分解又能得到汞和氧氣中,把得到的氧氣加到剩下的體積的氣體中,結果所得氣體跟空氣的性質完全一樣。45
根據資料卡片,請再補充本實驗使用汞的兩個優點,并說明依據。
④。
⑤。
(3)通過實驗,拉瓦錫得出了空氣由氧氣和氮氣組成,其中氧氣約占空氣總體積的結論。請根據現在的認識,對此結論予以補充。15。發布:2024/7/28 8:0:9組卷:173引用:12難度:0.32875.下列措施不利于減輕環境污染的是( )
A.露天焚燒垃圾 B.植樹、種草 C.使用氫氣等清潔能源 D.限制工業廢氣排放 發布:2024/7/28 8:0:9組卷:11引用:2難度:0.82876.實驗室常用下列裝置來制取氧氣:
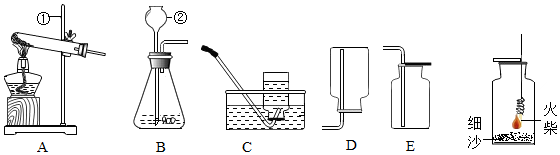
(1)寫出標有序號的儀器名稱:①,②。
(2)在實驗室用過氧化氫溶液和二氧化錳混合制取氧氣時,其中二氧化錳起作用,選用的發生裝置為(填裝置的字母代號,下同),加熱高錳酸鉀制取較純凈的氧氣可選用的發生裝置為,應選用的收集裝置為,發生反應文字表達式為。氧氣的檢驗方法是。
(3)用高錳酸鉀加熱制氧氣時,試管口稍微向下傾斜的原因是,反應后發現水槽中的水變成了紫紅色,你應該補充的操作是。
(4)做鐵絲的燃燒實驗鋪少量細沙的原因,其文字表達式為。發布:2024/7/28 8:0:9組卷:13引用:2難度:0.52877.請用空氣的成分填空(可填寫物質名稱或化學符號)。
(1)澄清石灰水長期露置于空氣中,因與發生化學反應而出現白膜;
(2)食品長期存放過程中容易因與發生化學反應而變質;
(3)酥脆的餅干露置于空氣中,因吸收而變軟;
(4)利用物理方法分離空氣,可以得到大量和。發布:2024/7/28 8:0:9組卷:1引用:2難度:0.82878.最早通過實驗得出空氣是由氧氣和氮氣組成的科學家是( )
A. 
舍勒B. 
拉瓦錫C. 
道爾頓D. 
普利斯特里發布:2024/7/28 8:0:9組卷:39引用:3難度:0.92879.下列描述屬于氧氣化學性質的是( )
A.通常狀況下,氧氣是無色、無味的氣體 B.通過低溫加壓,可使氧氣液化成淡藍色的液體 C.氧氣難溶于水 D.氧氣是一種性質比較活潑的氣體,能氧化許多物質 發布:2024/7/28 8:0:9組卷:76引用:6難度:0.92880.下列有關氧氣的“自述”,錯誤的是( )
A.我不易溶于水 B.我具有可燃性 C.我有氧化性 D.我的化學性質比較活潑 發布:2024/7/28 8:0:9組卷:30引用:3難度:0.5



