2024-2025學年山東省濱州市濱城區九年級(上)期末化學試卷
發布:2025/6/30 3:0:10
一、選擇題(本大題包括16小題,每小題只有一個選項符合題意,每小題3分,共48分。)
-
1.樂樂用二氧化錳催化分解雙氧水的實驗中,發現反應速度先快后慢.他猜測該反應為放熱反應,溫度升高加快了反應。為此,他采用恒溫箱、氣體發生裝置設計了如下表所示的兩組實驗,若樂樂的猜想正確,則實驗制得氧氣的質量隨時間變化的曲線圖正確的是( )
組別 溫度 雙氧水量 雙氧水溶質質量分數 二氧化錳 甲 25℃ 10克 10% 0.5克 乙 55℃ 10克 10% 0.5克 A. 
B. 
C. 
D.  組卷:5引用:1難度:0.6
組卷:5引用:1難度:0.6 -
2.工業上常用乙炔燃燒產生的高溫火焰來切割金屬.若用R表示乙炔的化學式,其燃燒的化學方程式為,2R+5O2
4CO2+2H2O,則乙炔的化學式是( )點燃A.C2H2 B.C2H4 C.C2H6 D.C2H5OH 組卷:6引用:2難度:0.7 -
3.如圖裝置可以用來發生、洗滌、干燥、收集某些氣體(不考慮尾氣處理)。該裝置可用于( )
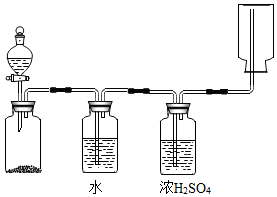
A.二氧化錳催化雙氧水分解制備氧氣 B.KClO3受熱分解制備氧氣 C.鋅和稀鹽酸反應制備氫氣 D.碳酸鈣和稀鹽酸反應制備二氧化碳 組卷:172引用:3難度:0.3 -
4.下列關于“酒精溫度計遇冷讀數下降”的微觀解釋正確的是( )
A.微粒間間隔減小 B.微粒體積縮小 C.微粒停止運動 D.微粒種類發生變化 組卷:1引用:1難度:0.6 -
5.磷酸二氫銨(化學式為NH4H2PO4)加熱發生如下反應:aNH4H2PO4
bH2O↑+cNH3↑+dX.已知23.0g磷酸二氫銨完全分解得到5.4g水蒸氣和3.4g氨氣。固體物質X既不能燃燒也不能支持燃燒。則下列說法正確的是( )△A.固體物質X的質量為7.1g B.b:c=2:3 C.固體物質X化學式為P2O5 D.a=b+c+d 組卷:74引用:1難度:0.7 -
6.下列實驗設計正確的是( )
A.用10mL量筒量取6.55mL的稀鹽酸 B.用水電解實驗說明水由氫、氧元素組成 C.用活性炭使硬水轉化為軟水 D.用木炭代替紅磷做空氣氧氣含量測定的實驗 組卷:29引用:1難度:0.5 -
7.5月上旬,一枚用于探傷的放射源銥192(其原子中含有77個質子和115個中子)在南京丟失,引起了社會的廣泛關注.下列有關說法正確的是( )
A.該元素屬于金屬元素 B.該元素的原子序數是192 C.該原子的核外有115個電子 D.該原子的相對原子質量為192 g 組卷:33引用:3難度:0.9 -
8.下列圖像能正確反映其對應關系的是( )
A. 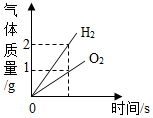
電解水B. 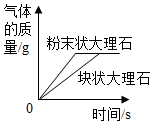
向兩份相等質量的塊狀大理石和粉末狀大理石中分別加入過量的等濃度的稀鹽酸C. 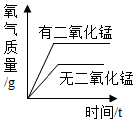
兩份完全相同的雙氧水在有無MnO2的情況下產生O2D. 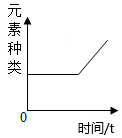
紅磷在密閉容器中燃燒組卷:51引用:1難度:0.6 -
9.配制溶質質量分數為7.3%的稀鹽酸,下列操作正確的是( )
A. 
吸取濃鹽酸B. 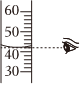
讀取液體體積C. 
攪拌溶液D. 
裝瓶貼標簽組卷:130引用:3難度:0.8 -
10.分類是學習化學的一種重要方法。以下分類正確的是( )
選項 歸類 物質 A 黑色固體 氧化銅、四氧化三鐵、氧化鎂 B 由分子構成的物質 水、二氧化碳、氯化鈉 C 可直接加熱的儀器 燒杯、蒸發皿、漏斗 D 緩慢氧化 金屬生銹、食物變質、呼吸作用 A.A B.B C.C D.D 組卷:7引用:1難度:0.7 -
11.中國芯彰顯中國“智”造。芯片的基材主要是高純硅,其反應微觀示意圖如圖,下列說法中錯誤的是( )
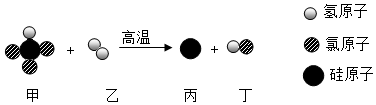
A.一個甲分子中有三個氯原子 B.乙的化學式是H2 C.在該反應中乙和丙的質量比為1:14 D.該反應中乙和丁的分子個數比為1:1 組卷:242引用:6難度:0.5 -
12.下列敘述不正確的是( )
A.物質溶于水時常常伴隨著能量的變化 B.飽和溶液中溶質的質量分數一定大于不飽和溶液中溶質的質量分數 C.利用乳化作用可以更好的除去衣服上的油污 D.外界條件不改變,溶質不會從溶液中分離出來 組卷:21引用:2難度:0.6 -
13.鋅是人體生長發育、維持器官正常功能不可缺少的微量元素,補鋅可用葡萄糖酸鋅,已知葡萄糖酸鋅的化學式為C12H22O14Zn.下列有關敘述正確的是( )
A.葡萄糖酸鋅的相對分子質量為455 B.葡萄糖酸鋅中含有49個原子 C.葡萄糖酸鋅中各元素的質量比為12:22:14:1 D.葡萄糖酸鋅屬于有機高分子 組卷:2引用:1難度:0.9 -
14.一些物質的近似pH如圖,下列有關說法正確的是( )

A.蘋果汁的酸性比純鮮牛奶的酸性弱 B.肥皂水的堿性比爐具清潔劑的堿性強 C.廁所清潔劑與爐具清潔劑能混用 D.人被某些蚊蟲叮咬后可涂抹肥皂水以減輕痛癢 組卷:818引用:18難度:0.5 -
15.下列各組物質的溶液,不用其他試劑,用觀察或組內物質相互混合的方法就能鑒別出來的是( )
A.CuCl2、KOH、MgCl2、NaCl B.Ba(NO3)2、NaCl、H2SO4、Na2SO4 C.CaCl2、AgNO3、KCl、HNO3 D.Ca(NO3)2、HCl、Na2CO3、HNO3 組卷:664引用:9難度:0.5 -
16.下列變化屬于化學變化的是( )
A.冰雪融化 B.木材制成桌椅 C.紙張燃燒 D.濕衣服晾干 組卷:5引用:6難度:0.9
二、填空題(本題包括6小題,共30分)
-
17.化學用語是學習化學的基本工具。
(1)用數字和化學符號表示:2個氫原子。
(2)寫出人體中缺少時易得佝僂病的元素符號。
(3)寫出三氧化二鐵的化學式,并標出鐵元素的化合價。組卷:5引用:1難度:0.5 -
18.砷華(化學式為As2O3),中藥名砒霜。北宋《本草衍義》對精制砒霜過程有如下敘述:“取砒之法,將生砒就置火上,以器覆之,令砒煙上飛著覆器,遂凝結累然下垂如乳,尖長者為勝,平短者次之”。
(1)“砒煙上飛,遂凝結尖長者”該過程發生了(選填“物理”或“化學”)變化,As2O3中,砷元素的化合價為。
(2)單質砷是一種青灰色易碎的半導體非金屬晶體。可以采用碳還原三氧化二砷,二者混合加熱至800℃得到砷和一種有毒的氣體氧化物。寫出該反應的化學方程式:。
(3)含砷化合物會給人類、環境帶來一定危害。工業上通過調節含砷溶液的pH,用吸附劑使之沉淀除去。測定pH的具體操作是用玻璃棒蘸取待測液于pH試紙上,待顏色穩定后,與對比,讀出數值;含砷溶液若原來呈酸性,測定pH前,將試紙潤濕,測量結果將(選填“偏大”、“偏小”或“不變”)。
(4)希臘哲學家亞里士多德在其著作中記載了雄黃(化學式As4S4)、雌黃(化學式As2S3)是提取砷的主要礦物原料,兩種物質化學性質存在差異的原因是(從微觀角度解釋),再舉一事例說明:。組卷:54引用:1難度:0.5 -
19.化學是在分子、原子層次上研究物質的性質與變化。
(1)研究人員成功研制出一種納米纖維催化劑,可將CO2轉化成液體燃料甲醇,此反應被廣泛應用于合成淀粉等技術中,其微觀示意圖如圖所示(圖中的微粒恰好完全反應)。物質丁的化學式為。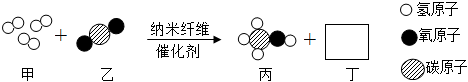
(2)某治療胃酸過多的藥物,它的主要成分是鋁碳酸鎂:AlMg(OH)3CO3,與鹽酸反應的化學方程式為:AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2↑。該物質中含有Al3+、Mg2+、OH-和。結合該物質與鹽酸反應方程式分析,該藥物起抗酸作用的微粒是CO2-3。組卷:17引用:2難度:0.5 -
20.A~H是初中化學中常見的物質如圖為這些物質的相互轉化關系圖,其中E為黑色固體,H為藍色沉淀,部分生成物與反應條件已省略。請回答下列問題:
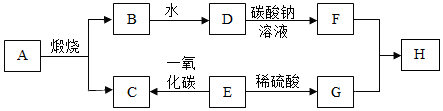
(1)B和水反應屬于(填“放熱”或“吸熱”)反應;F物質的俗稱是(寫一種)。
(2)寫出C物質的一種用途:。
(3)H的化學式為;在相互轉化過程中沒有涉及的基本反應類型是。
(4)E→G反應的化學方程式為。
(5)D→F反應的化學方程式為。組卷:11引用:3難度:0.4 -
21.在日常生活里,要根據不同的火情使用相應的滅火方法.例如:實驗室酒精燈起火常用
來撲滅;炒菜油鍋起火常用來撲滅;一般火災常用撲滅,油類火災常用來撲滅;書庫起火常用撲滅.組卷:15引用:1難度:0.5 -
22.實驗室用銅輝礦(主要成分為Cu2S,含少量Fe2O3、SiO2雜質)制備某種堿式碳酸銅【Cua(OH)b(CO3)c?dH2O】的主要流程如下。(已知:SiO2、MnO2不溶于水也不溶于酸)
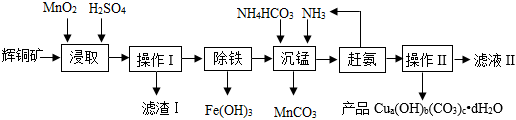
(1)操作Ⅰ和操作Ⅱ中玻璃棒的作用是。
(2)“浸取”步驟中氧化鐵與稀硫酸反應的化學方程式為,還會發生反應2MnO2+Cu2S+4H2SO4=2MnSO4+2CuSO4+S↓+4H2O,則濾渣Ⅰ中有。(填序號)
A.S
B.MnO2
C.SiO2
D.Fe2O3
(3)部分陽離子以氫氧化物形式沉淀時溶液的pH見下表:
“除鐵”步驟中,控制適宜的pH范圍為沉淀物 Fe(OH)3 Cu(OH)2 Mn(OH)2 開始沉淀 2.7 5.2 8.3 完全沉淀 3.2 6.4 9.8 。
(4)“沉錳”步驟中發生的反應為:MnSO4+NH4HCO3+NH3=MnCO3↓+X,X的化學式為。組卷:17引用:2難度:0.5
三、實驗題(本題包括1小題,共12分)
-
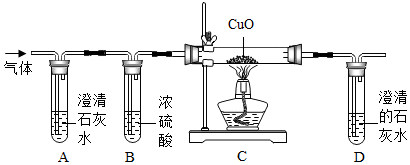 23.草酸又名乙二酸,廣泛存在于植物源食品中.草酸有毒,對皮膚、黏膜有刺激及腐蝕作用,極易經表皮、黏膜吸收引起中毒.
23.草酸又名乙二酸,廣泛存在于植物源食品中.草酸有毒,對皮膚、黏膜有刺激及腐蝕作用,極易經表皮、黏膜吸收引起中毒.
【提出問題】草酸的成分是什么?它有什么性質?
【查閱資料】Ⅰ.草酸是一種有機酸,又名乙二酸,化學式為H2C2O4;
Ⅱ.草酸在濃硫酸的催化作用下,隔絕空氣并加熱會發生分解反應.
【實驗探究】
(1)向盛有草酸溶液的試管中滴加紫色石蕊試液,觀察到溶液顏色變成,說明草酸溶液顯酸性.
(2)小明同學根據草酸中含有H、O元素,推測出生成物中肯定有.
(3)生成物中可能有碳的氧化物,小軍提出猜想:
①猜想Ⅰ:只有CO2,猜想Ⅱ:只有CO,猜想Ⅲ:
他們將草酸分解產生的氣體通過如圖的裝置(假設A、B裝置都是充分反應).
②實驗時,裝置A和D中澄清石灰水均變渾濁,證明猜想成立,澄清石灰水變渾濁的化學方程式為.
③實驗時裝置B的作用是;
④實驗時裝置C中的現象是;
【討論交流】從環保角度看,該裝置存在明顯的缺陷,處理方法是.
【實驗結論】草酸分解的化學方程式是:.組卷:18引用:1難度:0.5
四、計算題(本題包括1小題,共10分)
-
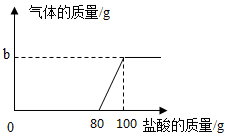 24.在實驗室中,化學興趣小組同學發現了一瓶敞口的氫氧化鈉固體。他們對該固體的成分進行了定量實驗分析:稱取固體21.3g放入錐形瓶中,加入一定量的水配成50g溶液,再向錐形瓶中依次滴加20g鹽酸充分反應。測得部分數據及圖像如圖表:
24.在實驗室中,化學興趣小組同學發現了一瓶敞口的氫氧化鈉固體。他們對該固體的成分進行了定量實驗分析:稱取固體21.3g放入錐形瓶中,加入一定量的水配成50g溶液,再向錐形瓶中依次滴加20g鹽酸充分反應。測得部分數據及圖像如圖表:
請根據有關信息回答問題:第1次 第2次 第3次 第4次 第5次 第6次 加入鹽酸的質量 20 20 20 20 20 20 錐形瓶中物質的質量 70 90 a 130 147.8 167.8
(1)a的數值為;b的數值為。
(2)興趣小組的同學通過實驗,得出該試劑已部分變質的結論,依據是(通過實驗數據和圖像做出你的分析)。
(3)該固體中氫氧化鈉的質量是克。(不要求計算過程)組卷:24引用:1難度:0.5


