滬教版九年級上冊《第5章 金屬的冶煉與利用》2021年單元測試卷(6)
發布:2025/7/2 17:0:11
一、單選題
-
1.自然界的礦物含量非常豐富,我國蘊藏了多種自然界稀少的金屬礦物.在下列礦物中,不屬于金屬礦物的是( )
A.石灰石 B.赤鐵礦 C.黃銅礦 D.硫磺 組卷:42引用:5難度:0.7 -
2.對于碳的兩種氧化物,下列敘述正確的是( )
A.CO2和CO都可以溶于水得到酸 B.CO2和CO都是有毒氣體 C.CO2可用于燃料,CO可以滅火 D.CO和CO2在一定條件下可以相互轉化 組卷:87引用:2難度:0.6 -
3.下列有關做法正確的是( )
A.冬天用煤火取暖時,為防止一氧化碳中毒,可在室內多擺放盛滿水的容器 B.用活性炭凈水器降低自來水的硬度 C.用水基型滅火器來撲滅非水溶性可燃性液體引起的著火 D.鎢和錫的熔點接近,都可以用來制作燈絲 組卷:159引用:2難度:0.6 -
4.下列對露置在空氣中的氫氧化鈉溶液進行的有關實驗中,說法正確的是( )
A.取一定量溶液,滴入幾滴稀鹽酸,沒有氣泡產生,說明沒有變質 B.取一定量溶液,滴入硝酸鋇溶液,有白色沉淀產生,說明已經變質 C.取一定量溶液,滴入氯化鋇溶液,有白色沉淀產生,說明已經全部變質 D.取一定量溶液,滴入適量的澄清石灰水,有白色沉淀產生,過濾,向濾液中滴加酚酞試液,試液變紅,證明部分變質 組卷:194引用:2難度:0.5 -
5.加熱過氧化氫(H2O2)和二氧化錳的混合物制取氧氣時,反應中二氧化錳在此混合物中的質量分數(w)隨時間(t)變化的規律,用圖象表示如圖,其中正確的是( )
A. 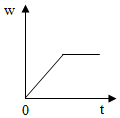
B. 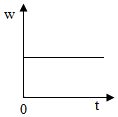
C. 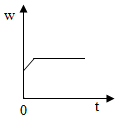
D. 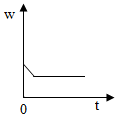 組卷:44引用:6難度:0.6
組卷:44引用:6難度:0.6 -
6.在反應A+3B=2C+3D中,A和B相對分子質量之比為9:11,已知1.8gA與一定量的B恰好完全反應,生成5.1gD。則該反應中B和C的質量比為( )
A.3:4 B.1:1 C.12:11 D.2:1 組卷:635引用:9難度:0.6 -
7.武廣高速全程都是無縫鐵軌.顯然,無縫鐵軌不可能一次成型,無縫鐵軌是在鋪設時將短軌通過如下反應原理:
2Al+Fe2O3Al2O3+2Fe焊接而成.該反應是( )高溫A.復分解反應 B.置換反應 C.分解反應 D.化合反應 組卷:6引用:3難度:0.9 -
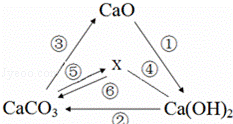 8.有關物質之間的部分轉化關系如圖所示,其中“-”表示物質之間能發生化學反應,“→”表示物質之間的轉化關系,下列說法中正確的是( )
8.有關物質之間的部分轉化關系如圖所示,其中“-”表示物質之間能發生化學反應,“→”表示物質之間的轉化關系,下列說法中正確的是( )A.物質X是二氧化碳,它是一種常見的有機化合物 B.圖中反應③可用于工業制取二氧化碳,該反應產生的生石灰用來做干燥劑 C.反應②一定是復分解反應 D.向Ca(OH)2溶液中加入CaO,所得溶液的溶質質量分數一定增大 組卷:18引用:0難度:0.9 -
9.人類開發利用下列金屬單質的時間順序與金屬活動性強弱存在著某種內在聯系。由此推斷,人類開發利用下列金屬的時間由先到后的順序是( )
A.Cu、Fe、Al B.Cu、Al、Fe C.Fe、Al、Cu D.Al、Cu、Fe 組卷:91引用:3難度:0.8 -
10.興趣小組的同學設計了如下實驗定量探究鐵銹蝕。
【實驗一】先檢查氣密性,將5g鐵粉和2g炭粉加入三頸燒瓶,t1時刻加入2mL飽和NaCl溶液后,再將一只裝有5mL稀鹽酸的注射器插到三頸燒瓶上,采集數據如圖1所示。
【實驗二】反應結束后,打開彈簧夾,測得常溫常壓圖1右側針筒最后讀數為VmL。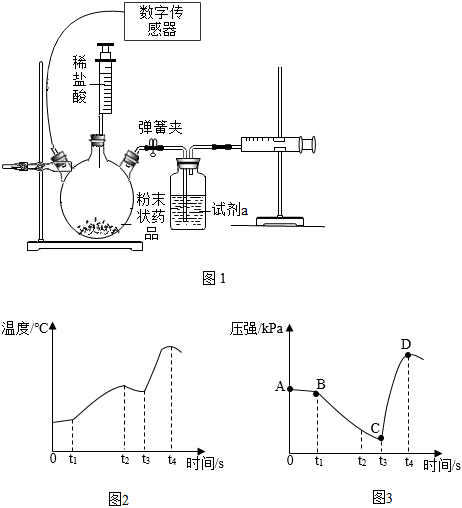
①對比圖3中AB段和BC段說明氯化鈉溶液是鐵銹蝕的催化劑
②t1~t3時刻裝置內溫度升高是因為鐵銹蝕放熱,壓強變小是因為鐵銹蝕消耗了氧氣
③t3時刻壓強突然變大的原因是注射器內鹽酸吸入燒瓶,鐵與鹽酸反應放出氫氣并放出熱
④試劑a為蒸餾水,目的是為了吸收稀鹽酸揮發出的HCl氣體
⑤若t3時三頸燒瓶中剩余物質過濾、洗滌、干燥后得到mg固體,常溫常壓時氫氣密度是dg/mL,則mg固體中鐵銹的質量分數為×100%,上述說法中不正確的個數有( )m-2-28vdmA.1個 B.2個 C.3個 D.4個 組卷:142引用:2難度:0.6 -
11.生產、生活中的物質千變萬化。下列變化屬于置換反應的是( )
A.鐵在潮濕的空氣中生銹 B.氯化鈉消除積雪 C.碳酸鈣作補鈣劑 D.不用鐵制容器配制波爾多液的原因 組卷:42引用:3難度:0.6 -
12.小兵同學對所學的化學知識歸納如下,其中正確的是( )
A.安全常識 B.日常生活經驗 檢驗天然氣是否泄漏:用打火機點燃
點燃一氧化碳:先驗純給自行車鏈條上油:防止生銹
消除馬桶內的水垢:用含有氫氧化鈉的潔廁劑C.物質的組成結構與其性質的關系 D.環境污染及其治理 生鐵和鋼的區別:含碳量不同
鈉原子和鈉離子的區別:最外層電子數不同控制汽車尾氣的排放:加長汽車尾氣排放管
減少酸雨的發生:用天然氣等清潔燃料替代煤A.A B.B C.C D.D 組卷:17引用:1難度:0.9 -
13.下列實驗操作能達到實驗目的的是( )
選項 實驗目的 實驗操作 A 測定某廢水的酸堿度 取樣,將濕潤的pH試紙浸入樣品中 B 鑒別澄清石灰水和NaOH溶液 取樣,加入稀鹽酸,觀察現象 C 除去KCl固體中混有少量的MnO2 溶解、過濾、蒸發結晶 D 配制濃度為0.9%的NaCl溶液 往100g水中加入0.9gNaCl固體 A.A B.B C.C D.D 組卷:5引用:1難度:0.5 -
14.下列歸納和推理,你認為不合理的是( )
A.生鐵和鋼,含碳量不同--性能不同 B.冰和干冰,組成元素不同--物質分類不同 C.金剛石和石墨,組成元素相同,原子排列方式不同--物理性質不同 D.一氧化碳和二氧化碳,組成元素相同,分子結構不同--化學性質不同 組卷:188引用:4難度:0.7 -
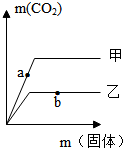 15.向等質量、相同濃度的稀鹽酸中分別加入足量的碳酸鈉固體和碳酸氫鈉固體,加入固體的質量和生成CO2質量的關系如圖所示。下列說法正確的是( )
15.向等質量、相同濃度的稀鹽酸中分別加入足量的碳酸鈉固體和碳酸氫鈉固體,加入固體的質量和生成CO2質量的關系如圖所示。下列說法正確的是( )A.甲表示碳酸鈉和稀鹽酸反應的情況 B.a點對應的溶液中溶質只有NaCl C.向b點對應溶液中滴入酚酞溶液,溶液顯紅色 D.從該圖像中可知,相同情況下,碳酸氫鈉固體與稀鹽酸反應的速率比碳酸鈉固體與稀鹽酸反應的速率快 組卷:420引用:5難度:0.5
二、填空題
-
16.金屬與酸反應的條件:(1)
,(2)。組卷:3引用:1難度:0.6 -
17.在金屬活動性順序中金屬鋁比鐵
(填活潑或不活潑)。但鋁比鐵的抗腐蝕性能強,其原因是。在AgNO3、Zn(NO3)2和Cu(NO3)2的混合溶液中加入一定量的鐵粉,充分反應后過濾。若向濾渣中加入稀鹽酸,有氣泡產生。則濾渣中一定有,濾液中一定有;若向濾液中加入稀鹽酸,有白色沉淀,反應化學方程式為,濾液中一定有。組卷:13引用:2難度:0.5 -
18.A、B、C、D、E、F是初中化學中的六種常見物質。A、B中含有相同的元素,A為暗紫色固體,A在一定的條件下可以生成B、C、D,其中D是單質;一種銀白色固體E可以在D中劇烈燃燒,火星四射,生成黑色固體F。
(1)請寫出物質的化學式。A:;B:;C:;D:;E:;F:。
(2)寫出符號表達式,標明反應類型
①A在一定條件下生成D:。②E在D中燃燒:。組卷:14引用:2難度:0.8 -
19.如圖1所示裝置常用于實驗室制取少量氣體。
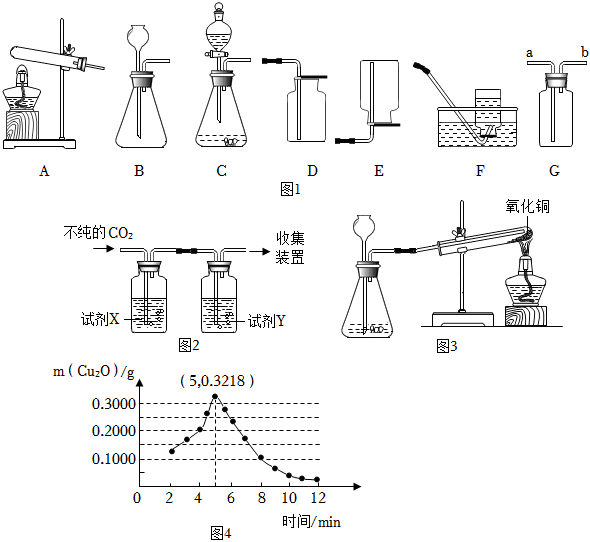
Ⅰ.用高錳酸鉀制取O2
(1)用高錳酸鉀制取O2的化學方程式為,發生裝置應選用圖1中(填字母)。
(2)①用裝置F收集O2,以下操作正確的是(填字母)。
A.當導管口出現均勻且連續氣泡時,將其伸入集氣瓶口
B.當集氣瓶中水被排盡,瓶口有大氣泡向外冒出時取出導管
C.將集氣瓶口朝下提出水面,再蓋上玻璃片,倒放在桌面上
D.收集結束后導管仍要放在水中,并立即熄滅酒精燈,以防失火
②用裝置G收集O2,氣體應從(填“a”或“b”)端通入,在另一端用檢驗。
Ⅱ.用大理石和稀鹽酸制取CO2
(3)用大理石和稀鹽酸制取CO2的化學方程式為。
(4)①制得的CO2中常混有HCl氣體,是因為鹽酸具有。
②用圖2所示裝置除去HCl氣體,并獲得干燥的CO2。
收集裝置應選用圖1中(填字母)。裝置中所盛試劑應選用下面表格中的組(填字母)。
(CO2不與飽和NaHCO3溶液反應)
Ⅲ.制取H2進行還原氧化銅實驗A組 B組 C組 D組 X 濃硫酸 濃硫酸 飽和NaHCO3溶液 飽和NaOH溶液 Y 飽和NaOH溶液 飽和NaHCO3溶液 濃硫酸 濃硫酸
用圖3所示裝置進行H2還原CuO的實驗,完全反應的化學方程式為H2+CuOCu+H2O,但實驗后試管中得到紅色固體也可能是銅和氧化亞銅(Cu2O)組成的混合物。氧化亞銅為紅色固體,在空氣中能溶于氨水得到藍色溶液。△
(5)①實驗室使用鋅粒和稀硫酸反應制取氫氣,該反應的化學方程式為。
②為證明固體產物中有Cu2O,需進行的操作及現象為。
(6)現稱取若干份質量均為0.6000g的CuO,在相同實驗條件下進行反應。根據加熱不同的時間,檢測所得固體中Cu2O的質量,結果如圖4所示。
①0.6000g的CuO和H2完全反應可得金屬銅的質量為多少克?(寫出計算過程)
②由圖4,在H2還原CuO反應過程中,固體中Cu2O質量的變化趨勢是。
③為確保H2還原CuO所得固體產物不含Cu2O,應采取的措施是。
(7)某同學對H2還原CuO的反應過程提出如下假設:該過程經歷了兩個反應,化學方程式為H2+2CuOCu2O+H2O,H2+Cu2O△2Cu+H2O。且在同一條件下兩個反應同時進行。請結合圖4,通過計算。分析“在同一條件下兩個反應能同時進行”這一假設是否合理△。組卷:192引用:2難度:0.1 -
20.小明同學欲通過實驗探究“用酒精燈給物質加熱時,應該用哪一層火焰”,請幫他完成實驗探究過程的設計,并根據實驗數據得出結論。
(1)提出問題:用酒精燈給物質加熱時,應該用哪一層火焰?
(2)作出預測:。
(3)實驗及結論:取三支試管,各加入3mL水,①將其中一支試管的底部放在酒精燈火焰上方約3cm處加熱;②將另一支試管的底部與燈芯接觸加熱;③將第三支試管的底部放在外焰部分加熱。記錄上述三種情況下將水加熱至沸騰所需時間。
(4)問題與討論:① ② ③ 加熱至沸騰所需的時間 57s 48s 25s 結論
①上述實驗三支試管中,各加入3mL水,即要求所取水的量相同,若不相同行嗎?為什么?
②若不用以上探究方法,你認為還有其他方法嗎?若有,請簡要敘述操作過程、現象及結論。組卷:93引用:8難度:0.5
三、推斷題
-
21.下列是我們已學的物質,其中M是暗紫色固體,其相互轉化關系如下:
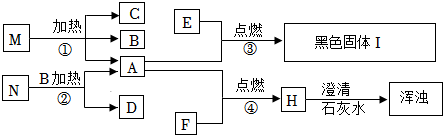
回答下列問題:
(1)寫出下列物質的化學式:A,M,I。
(2)寫出下列反應的文字表達式:
②,其反應的基本類型是。
③。
④。組卷:6引用:1難度:0.5 -
22.“真金不怕火煉”說明金在高溫下也不與
反應。組卷:13引用:1難度:0.5
四、實驗題
-
23.很多門把手都是銅質鍍鉻的,為了了解鉻與常見金屬鎂、銅在金屬活動性順序表中的相對位置關系,同學們進行如下探究活動:
【查閱資料】①鉻(Cr)是銀白色有光澤的金屬,在空氣中其表面能生成抗腐蝕性的致密氧化膜。鉻能與稀硫酸反應,生成藍色的硫酸亞鉻(CrSO?)溶液。
②在相同條件下,金屬與酸反應越劇烈,金屬活動性越強。
【猜想與假設】猜想三種金屬在金屬活動性順序表中的相對位置關系:
①Cr>Mg>Cu
②Mg>Cr>Cu
③Mg>Cu>Cr
【實驗過程】取大小相同的三種金屬薄片,用砂紙打磨光亮。進行如下實驗: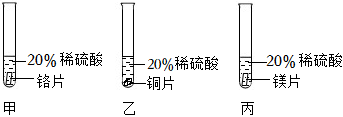
【實驗現象及結論】
①甲中可以觀察到鉻片表面產生氣泡緩慢,溶液逐漸變為藍色,發生反應的化學方程式為,可以得出鉻能與稀硫酸發生反應且反應速率較緩慢。
②乙中可以觀察到,可以得出銅不與稀硫酸反應。
③丙中可以觀察到鎂片表面有大量氣泡產生,反應比較劇烈,可以得出。
【實驗結論】三種金屬在金屬活動性順序表中的相對位置關系是。
【反思與評價】①用砂紙打磨金屬片的目的是。
②小明提出用硫酸銅溶液代替上述實驗中的稀硫酸也能得出三種金屬在金屬活動性順序表中的相對位置關系,小燕認為不可行,理由是。
③小紅認為只要選用三種藥品進行實驗就可以得出三種金屬在金屬活動性順序表中的相對位置關系,這三種藥品可以是。組卷:61引用:2難度:0.6
五、計算題
-
24.某小組用粗鋅測定某稀硫酸的溶質質量分數。取8.0g粗鋅于燒杯中,加入100.0g稀硫酸恰好完全反應(雜質不參加反應),燒杯中物質總質量為107.8g。請計算:
(1)生成氫氣的質量為g。
(2)稀硫酸的溶質質量分數。組卷:22引用:1難度:0.6 -
25.將25g含碳酸鈣80%的石灰石樣品放入燒杯中,加入稀鹽酸至恰好完全反應,共用去稀鹽酸150g(石灰石樣品中的雜質不參加反應)。請計算:
(1)生成二氧化碳的質量。
(2)反應后燒杯內剩余物質的總質量。組卷:24引用:2難度:0.6


