2022-2023學年四川省成都七中高二(下)期中化學試卷
發布:2024/9/5 3:0:9
一、選擇題(60分,每題3分,只有一個正確選項)
-
1.下列設備工作時,將化學能主要轉化為熱能的是( )
A.燃氣灶 B.鋅錳電池 C.風力發電 D.太陽能熱水器 



A.A B.B C.C D.D 組卷:55引用:5難度:0.8 -
2.生活處處都伴隨有化學,以下有關說法不正確的是( )
A.天然金剛石形成于地殼中 B.液晶介于液態和晶態之間,可用于制造顯示器 C.細胞雙分子膜的兩邊都親水 D.生物機體可以產生具有光學活性的分子 組卷:18引用:4難度:0.7 -
3.下列化學用語正確的是( )
A.基態鎂原子最外層電子云輪廓圖: 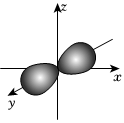
B.乙醛的比例模型(空間填充模型): 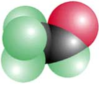
C. 中存在的大π鍵可以表示為π44CO2-3D.基態鐵原子的價層電子排布式:3d44s2 組卷:34引用:2難度:0.7 -
4.下列狀態的鈣中,電離最外層一個電子所需能量最大的是( )
A. 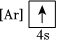
B. 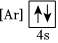
C. 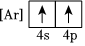
D. 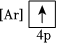 組卷:45引用:2難度:0.8
組卷:45引用:2難度:0.8 -
5.三氟化氯是極強助燃劑,能發生自耦電離:2ClF3?
+ClF-4,下列推測不合理的是( )ClF+2A.ClF3分子的中心原子雜化方式不是sp2 B.ClF3與Fe反應生成FeCl2和FeF2 C.ClF3分子是含有極性鍵的極性分子 D.BrF3比ClF3更易發生自耦電離 組卷:33引用:2難度:0.8 -
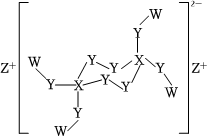 6.W、X、Y、Z是原子序數依次增大的短周期主族元素,且原子序數總和為25,Y是地殼中含量最多的元素,由這四種元素形成的某化合物結構如圖所示。下列敘述不正確的是( )
6.W、X、Y、Z是原子序數依次增大的短周期主族元素,且原子序數總和為25,Y是地殼中含量最多的元素,由這四種元素形成的某化合物結構如圖所示。下列敘述不正確的是( )A.W和Y可以組成離子化合物 B.化合物具有強氧化性,可殺菌消毒 C.X的最高價氧化物的水化物分子式為H2CO3 D.該化合物中的共價鍵有極性鍵和非極性鍵,都是σ鍵 組卷:24引用:1難度:0.5 -
7.某團隊報道了單硫代內酯單體實現了堅韌可回收塑料的目的。反應原理如圖所示(R為烴基)。
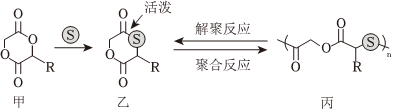
下列敘述錯誤的是( )A.聚合反應時,原子利用率為100% B.甲的水解產物均含有羥基 C.丙中sp3雜化的原子只有碳原子 D.乙中碳氧雙鍵活化了碳硫σ鍵 組卷:60引用:3難度:0.6 -
8.某元素的原子有16個不同運動狀態的電子,下列說法正確的是( )
A.該元素的最高價氧化物為兩性氧化物 B.基態原子中所有的電子占有3個能級,有9種空間運動狀態 C.基態原子中能量最高的電子的電子云的形狀為啞鈴形 D.若將該基態原子的電子排布式寫成1s22s22p63s23 3p2x違背了泡利原理p2y組卷:41引用:2難度:0.7
二、填空題(40分)
-
23.甲醇是一種基本的有機化工原料,用途十分廣泛。應用CO2催化加氫規模化生產甲醇是綜合利用CO2,實現“碳達峰”的有效措施之一。我國科學家研究發現二氧化碳電催化還原制甲醇的反應CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔH,需通過以下兩步實現:
Ⅰ.CO2(g)+H2(g)=CO(g)+H2O(g)ΔH1
Ⅱ.CO(g)+2H2(g)=CH3OH(g)ΔH2
(1)反應過程中各物質的相對能量變化情況如圖所示。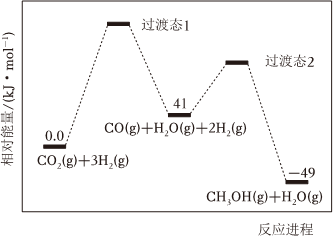
ΔH2=。
(2)若CO2(g)+3H2(g)=CH3OH(g)+H2O(g)ΔS=-175J?mol-1?K-1,下列溫度下反應能自發進行的是(填序號)。
A.5℃
B.10℃
C.50℃
D.500℃
(3)恒壓下,分別向無分子篩膜和有分子篩膜(能選擇性分離出H2O)的兩個同體積容器中通入1molCO2和3molH2,甲醇的產率隨溫度的變化如圖所示。溫度相同時,有分子篩膜的容器中甲醇的產率大于無分子篩膜的原因為。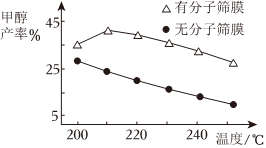
(4)按照n(CO2):n(H2)=1:3投料,在恒容密閉容器中進行反應,CO2的平衡轉化率隨溫度和壓強變化如圖所示。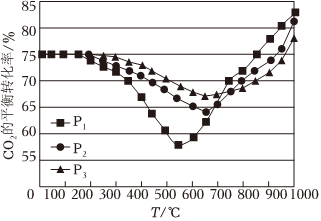
①壓強P1、P2、P3由大到小的順序是。
②壓強為P2時,溫度高于670℃之后,隨著溫度升高平衡轉化率增大的原因是。
③同時增大CO2的平衡轉化率和CH3OH的產率可采取的措施是。
④一種應用雙極膜(由陽離子和陰離子交換膜構成)通過電化學還原CO2制備甲醇的電解原理如圖所示。催化電極的電極反應式為,雙極膜內每消耗18g水,理論上石墨電極產生標準狀況下LO2。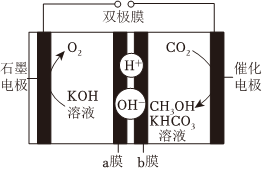 組卷:23引用:3難度:0.5
組卷:23引用:3難度:0.5 -
24.ⅤA族元素原子核外電子排布有著特殊性,能與其他元素組成結構、性質各異的化合物。回答下列問題:
(1)氮原子可以提供孤電子對與氧原子形成配位鍵,基態氧原子的價層電子發生重排提供一個空軌道,則重排后的氧原子價電子排布圖(軌道表達式)為,基態氧原子的價層電子不是重排結構,原因是不符合。
(2)沸點:PH3NH3(填“>”或“<”,下同),鍵角:AsO3-3。AsO3-4
(3)As、Ge、Se三種元素的第一電離能由大到小的順序是。
(4)基態As原子的價層電子排布式為,與互為等電子體的分子為AsO3-4(任寫一種)。
(5)雌黃(As2S3)中As原子的雜化方式為。
(6)根據如圖所示晶胞中,寫出該晶體的化學式。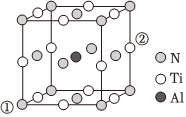 組卷:37引用:2難度:0.6
組卷:37引用:2難度:0.6


