2022年天津一中高考化學模擬試卷(4月份)
發布:2024/4/20 14:35:0
一、選擇題(單選,共36分)
-
1.第24屆北京冬奧會提出了“科技冬奧”理念,并將重點著力于做好此次冬奧會的科技支撐保障工作。下列說法不正確的是( )
A.使用二氧化碳跨臨界直冷制冰技術,與使用氟利昂作制冷劑的傳統制冰技術相比更加環保 B.有舵雪橇中的輕質高強度的碳纖維是一種有機高分子材料 C.采用紫外殺菌技術對手機和筆記本電腦進行消毒,這是因為紫外線能使蛋白質變性 D.采用氫燃料電池車,還開發了全新的車載光伏發電系統,體現了“綠色出行”的理念 組卷:56引用:1難度:0.6 -
2.下列表示不正確的是( )
A.乙炔的結構簡式HC≡CH B.KOH的電子式 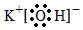
C.乙烷的球棍模型: 
D.氯離子的結構示意圖: 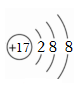 組卷:316引用:10難度:0.7
組卷:316引用:10難度:0.7 -
3.下列過程中,沒有發生酯化反應的是( )
A.用秸稈制燃料乙醇 B.用纖維素制取硝酸纖維 C.核苷酸聚合生成多聚核苷酸 D.白酒在陳化過程中產生香味 組卷:87引用:4難度:0.8 -
4.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.12g金剛石中含有C-C鍵4NA B.6.4gCaC2 固體中含有的離子總數為0.2NA C.已知H2(g)+I2(g)?2HI(g)ΔH=-11kJ/mol,當晶體I2與H2(g)反應生成2NA個HI(g)分子時,反應放出的熱量為11kJ D.1L0.01mol/L 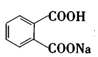 溶液中,
溶液中,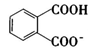 和
和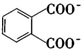 的數目之和為0.01NA組卷:57引用:1難度:0.5
的數目之和為0.01NA組卷:57引用:1難度:0.5 -
5.下列實驗操作或裝置正確的是( )
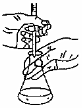
蒸發除去苯甲酸中的乙醇 除去水中的苯酚 實驗室純化工業乙酸乙酯 用氫氧化鈉溶液滴定醋酸溶液 A B C D A.A B.B C.C D.D 組卷:220引用:5難度:0.5
二、填空題(共64分)
-
15.實驗室以CuSO4?5H2O為原料制備[Cu(NH3)4]SO4?H2O并進行定量分析。
已知:CuSO4+4NH3?H2O═[Cu(NH3)4]SO4+4H2O
[Cu(NH3)4]2++4H+═Cu2++4NH+4
(1)配制溶液:稱取一定質量的CuSO4?5H2O晶體,放入錐形瓶中,溶解后滴加氨水,裝置A如圖所示(膠頭滴管中吸有氨水)。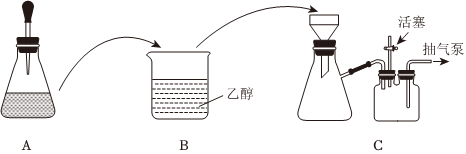
滴加氨水時,有淺藍色沉淀Cu2(OH)2SO4生成;繼續滴加氨水,沉淀消失,得到深藍色溶液[Cu(NH3)4]SO4。用離子方程式解釋由淺藍色沉淀生成深藍色溶液的原理:。
(2)制備晶體:將裝置A中溶液轉移至裝置B中,析出[Cu(NH3)4]SO4?H2O晶體;將裝置B中混合物轉移至裝置C的漏斗中,減壓過濾,用乙醇洗滌晶體2~3次;取出晶體,干燥。
①兩次轉移均需洗滌原容器,且將洗滌液也全部轉移,目的是。
②減壓過濾時,抽氣泵處于工作狀態,活塞需關閉,使裝置內產生負壓。洗滌晶體時,為了使乙醇與晶體充分接觸,提高洗滌的效果,要(填“打開”或“關閉”,下同)活塞后,向漏斗中加入乙醇至浸沒沉淀,待乙醇流下后,再活塞。
(3)廢液回收:從含有[Cu(NH3)4]SO4、乙醇和一水合氨的廢液中回收乙醇并獲得CuSO4和(NH4)2SO4的混合溶液,應加入的試劑是(填名稱),回收乙醇的實驗方法為。
(4)用沉淀法測定晶體中的含量:稱取一定質量的[Cu(NH3)4]SO4?H2O晶體,加適量蒸餾水溶解,向其中滴加足量SO2-4溶液,攪拌,過濾,洗滌,干燥,稱量沉淀的質量。如何檢驗沉淀已經洗凈。
(5)探究小組用滴定法測定CuSO4?5H2O(Mr=250)含量。取ag試樣配成100mL溶液,每次取20.00mL,消除干擾離子后,用cmol/LEDTA(H2Y2-)標準溶液滴定至終點,平均消耗EDTA溶液bmL。滴定反應如下:Cu2++H2Y2-=CuY2-+2H+。寫出計算CuSO4?5H2O質量分數的表達式ω=;
下列操作會導致CuSO4?5H2O含量的測定結果偏高的是。
a.未干燥錐形瓶
b.滴定終點時滴定管尖嘴中產生氣泡
c.未除凈可與EDTA反應的干擾離子組卷:86引用:1難度:0.4 -
16.甲醇既是重要的化工原料,又是一種可再生能源,具有開發和應用的廣闊前景,研究甲醇具有重要意義。
(1)利用CO2和H2合成甲醇是CO2資源化利用的重要方法。
①若H2(g)和CH3OH(l)的燃燒熱分別為ΔH=-285.8kJ/mol和ΔH=-726.5kJ/mol,則由CO2和H2反應生成液態甲醇和液態水的熱化學方程式為。此反應的活化能Ea(正)Ea(逆)(填“>”或“<”),該反應應選擇高效催化劑(填“高溫”或“低溫”)。
②下列措施能使CO2的平衡轉化率提高的是(填序號)。
A.增大壓強
B.升高溫度
C.增大H2與CO2的投料比
D.改用更高效的催化劑
(2)利用CH4與O2在催化劑的作用下合成甲醇。
主反應:CH4+O2(g)?CH3OH(g) ΔH12
副反應:CH4+2O2(g)?CO2(g)+2H2O(g) ΔH
科技工作者結合實驗與計算機模擬結果,研究了CH4、O2和H2O(g)(H2O的作用是活化催化劑)按照一定體積比在催化劑表面合成甲醇的反應,部分反應歷程如圖乙所示(吸附在催化劑表面的物種用“*”標注,TS代表過渡態)。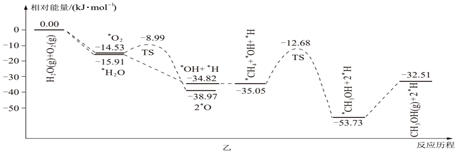
①在催化劑表面上更容易被吸附的是(填“H2O”或“O2”)。
②該歷程中正反應最大能壘(活化能)為kJ/mol,寫出該步驟的化學方程式:。
③在恒溫的剛性密閉容器中,分別按照CH4、O2的體積比為2:1以及CH4、O2、H2O(g)的體積比為2:1:8反應相同的時間,所得產物的選擇性[如甲醇的選擇性=],如圖丙所示:n(CH3OH)n(CH3OH)+n(CO2)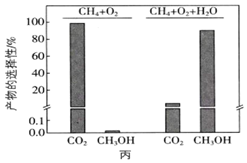
向反應體系中加入H2O(g)能夠顯著提高甲醇選擇性的原因:。向上述剛性密閉容器中按照體積比2:1:8充入CH4、O2和H2O(g),在450K下達平衡時,CH4的轉化率為50%,CH3OH的選擇性為90%,則副反應的壓強平衡常數Kp=(Kp是以分壓代表的平衡常數,分壓=總壓×物質的量分數)(計算結果保留1位小數)。
(3)可利用電解的方法將CO2轉化為CH3OH,請寫出在酸性條件下的陰極反應式:。組卷:66引用:2難度:0.5


