2023年北京市海淀區高考化學查漏補缺試卷
發布:2024/7/11 8:0:9
一、化學實驗:
-
1.下列實驗過程中觀察到的現象與氧化還原反應有關的是( )
A.H2S溶液和H2SO3溶液混合,產生淺黃色沉淀 B.向常溫下c(OH-)=1×10-12mol?L-1的溶液中滴加石蕊溶液,顏色變紅 C.向白色Mg(OH)2懸濁液中滴加0.1mol?L-1的FeCl3溶液,產生紅褐色沉淀 D.將少量CH3COONH4固體加入0.1mol?L-1的CH3COOH和甲基橙混合溶液中,溶液顏色變黃 組卷:56引用:1難度:0.7 -
2.將濃氨水分別滴加到下列試劑中,產生的實驗現象、體現出的NH3?H2O性質以及對應的方程式不正確的是( )
實驗 試劑 現象 性質 方程式 A 滴有酚酞的蒸餾水 溶液變紅 堿性 NH3?H2O═ +OH-NH+4B 氯氣 產生白煙 還原性 3Cl+8NH3?H2O═N2+6NH4Cl+8H2O C 燒堿固體 產生刺激性氣味的氣體 不穩定性 NH3?H2O NH3↑+H2O△D CuSO4溶液 溶液最終變為深藍色 可形成配合物 Cu2++4NH3?H2O═[Cu(NH3)4]2++4H2O A.A B.B C.C D.D 組卷:187引用:4難度:0.7 -
3.為除去某NaCl樣品中少量的
,取適量該NaCl樣品溶解后,依次進行如圖操作:SO2-4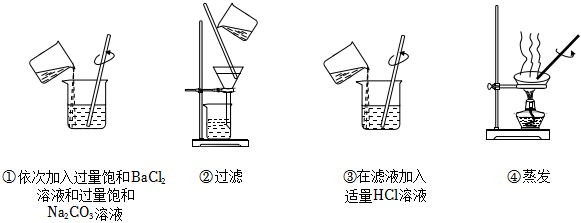
已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
取少量提純后的NaCl固體,加水溶解,向溶液中滴加BaCl2溶液,仍能看到白色渾濁。為提高的去除率,下列改進操作有效的是( )SO2-4A.在步驟①加入兩種溶液之間增加一次過濾操作 B.在步驟②后增加沉淀的洗滌操作 C.在步驟③中加入略過量的HCl溶液 D.步驟④改為小火加熱濃縮,之后降溫結晶 組卷:76引用:3難度:0.7 -
4.某實驗小組探究過量甲醛與新制氫氧化銅的反應。
提出猜想:HCHO+Cu(OH)2Cu+CO↑+2H2O△
已知:ⅰ.CO+2Ag(NH3)2OH═2Ag↓+(NH4)2CO3+2NH3
ⅱ.Cu2O+H2SO4═Cu+CuSO4+H2O
下列說法不正確的是( )實驗步驟 實驗裝置及內容 實驗現象 步驟1 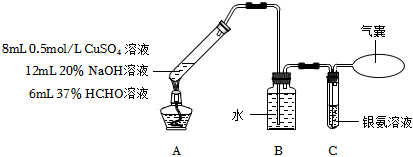
反應結束后,A中生成紅色固體,C無明顯變化 步驟2 將A中混合物過濾,洗滌所得固體,取少量固體于試管中,加入稀硫酸,振蕩 無明顯現象 步驟3 取步驟2中的濾液于試管中,加入足量稀鹽酸 無明顯現象 A.配制銀氨溶液時,應向稀AgNO3溶液中加入稀氨水,至產生的沉淀恰好溶解 B.裝置B的主要作用是除去揮發的甲酸,防止干擾CO的檢驗 C.步驟3目的是檢驗反應后溶液中是否存在 CO2-3D.該實驗中,過量甲醛與新制氫氧化銅可能發生的反應為:HCHO+Cu(OH)2+NaOH Cu+HCOONa+2H2O△組卷:94引用:6難度:0.4 -
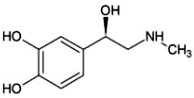 5.腎上腺素具有提高心臟收縮力、擴張氣管的功能,其結構如圖所示。配制腎上腺素注射劑時要加抗氧化劑、遮光密封置陰涼處存放。下列有關腎上腺素說法不正確的是( )
5.腎上腺素具有提高心臟收縮力、擴張氣管的功能,其結構如圖所示。配制腎上腺素注射劑時要加抗氧化劑、遮光密封置陰涼處存放。下列有關腎上腺素說法不正確的是( )A.分子中僅有1個手性碳原子 B.可用FeCl3溶液檢驗腎上腺素中的酚羥基 C.具有還原性,因此配制注射劑時要加抗氧化劑 D.腎上腺素的同分異構體中存在含有酰胺基的芳香族化合物 組卷:67引用:4難度:0.5
第二部分
-
16.某小組同學用銀氨溶液制備銀鏡,并探究反應后銀鏡的處理方法。
Ⅰ.銀鏡的制備
(1)配制銀氨溶液時,隨著氨水滴加到硝酸銀溶液中,觀察到先產生棕黃色沉淀,然后沉淀消失,形成無色透明的溶液。該過程中發生的反應有:
a.AgNO3+NH3?H2O═AgOH↓+NH4NO3
b.AgOH+2NH3?H2O═Ag(NH3)2OH+2H2O
c.2AgOH(白色沉淀)═Ag2O(棕黑色沉淀)+H2O
d.(補全d的反應)。
(2)寫出乙醛與銀氨溶液反應的化學方程式。
(3)該小組探究銀鏡反應的最佳條件,部分實驗數據如表:
①推測當銀氨溶液的量為1mL,乙醛的量為3滴,水浴溫度為60℃,出現銀鏡的時間范圍是實驗序號 銀氨溶液/mL 乙醛/滴 水浴溫度/℃ 出現銀鏡時間/min 1 1 3 65 5 2 1 5 65 t 3 1 3 50 6 。
②推測實驗2中的t5min(填“大于”、“小于”或“等于”)。
Ⅱ.銀鏡的處理
(4)取一支附有銀鏡的試管,加入2mL稀硝酸,銀鏡較快溶解,有氣泡產生,該反應的離子方程式為。
(5)在兩支含等量銀鏡的試管中分別加入2mL1mol?L-1FeCl3和Fe(NO3)3溶液,充分振蕩,兩支試管中均發生不同程度的溶解,前者銀鏡溶解的量明顯多于后者,且前者有灰色沉淀生成。結合化學用語解釋FeCl3和Fe(NO3)3溶液溶解銀鏡效果好的原因。
(6)取一支含銀鏡的試管,加入5mL10%H2O2溶液,振蕩,發生劇烈反應,產生大量氣泡,銀鏡在氣泡的影響下呈顆粒狀逐漸脫離試管內壁,并沉積在試管底部。結合實驗現象,小組同學認為Ag催化H2O2分解,該過程分為兩步:
ⅰ.2Ag+H2O2═Ag2O+H2O;
ⅱ.(補全ⅱ的反應)。
(7)反思:根據上述過程,清洗銀鏡可選擇的試劑是,此試劑的優點是。組卷:23引用:1難度:0.5 -
17.某小組同學探究銅和濃硝酸的反應,進行如下實驗:
實驗1:分別取3mL濃硝酸與不同質量的銅粉充分反應,銅粉完全溶解,溶液顏色如表:
(1)寫出銅和濃硝酸反應的離子反應方程式:編號 ① ② ③ ④ ⑤ 銅粉質量/g 0.1 0.2 0.3 0.4 0.5 溶液顏色 綠色 草綠色 藍綠色偏綠 藍綠色偏藍 藍色 。
(2)小組同學認為溶液呈綠色的可能原因是:
猜想1:硝酸銅濃度較高,溶液呈綠色;
猜想2:NO2溶解在硝酸銅溶液中,溶液呈綠色。
依據實驗1中的現象,判斷猜想1是否合理,并說明理由:。
(3)取⑤中溶液,(填操作和現象),證實猜想2成立。
(4)小組同學進行如下實驗也證實了猜想2成立。
實驗2:向①中溶液以相同流速分別通入N2和空氣,觀察現象。
結合上述實驗現象,下列推測合理的是通入氣體 氮氣 空氣 現象 液面上方出現明顯的紅棕色氣體,25min后溶液變為藍色 液面上方出現明顯的紅棕色氣體,5min后溶液變為藍色 (填字母序號)。
a.①中溶液通入N2時,N2被緩慢氧化為NO2
b.①中溶液里某還原性微粒與綠色有關,通入空氣時較快被氧化
c.空氣中的CO2溶于水顯酸性,促進了溶液變藍色
d.加熱溶液①后,可能觀察到溶液變藍的現象
(5)小組同學繼續探究實驗2中現象的差異,并查閱文獻知:
ⅰ.“可溶性銅鹽中溶解亞硝酸 (HNO2)”可能是實驗①中溶液顯綠色的主要原因
ⅱ.NO2在溶液中存在:
反應1:2NO2+H2O?HNO3+HNO2(慢)
反應2:2HNO2?NO2+NO+H2O(快)
解釋實驗2中“通入氮氣變藍慢,通入空氣變藍快”的原因。
(6)小組同學為確認亞硝酸參與了形成綠色溶液的過程,繼續進行實驗。
實驗3:取3份等體積的①中綠色溶液,分別加入不同物質,觀察現象。
實驗中加入的固體物質是加入物質 固體 3滴30%H2O2溶液 3滴水 現象 溶液綠色變深 溶液迅速變為藍色 溶液顏色幾乎不變 (填化學式),加入H2O2后溶液迅速變藍可能的原因是(用化學方程式表示):H2O2+2NO2═2HNO3,,。組卷:86引用:7難度:0.5


