2019-2020學年廣西百色高級中學高一(下)開學化學試卷
發布:2024/11/14 9:0:2
一、單選題(本大題共16小題,共48.0分)
-
1.設NA為阿伏加德羅常數的值,下列說法中正確的是( )
A.常溫常壓下,11.2 L氧氣含有的原子數目為NA B.14 gN2和N4 組成的混合氣體中含有的原子數為NA C.常溫常壓下,1mol 氦氣含有的核外電子數為4NA D.1 mol/LCaCl2 溶液中含有的氯離子數目為2NA 組卷:36引用:3難度:0.8 -
2.下列離子方程式書寫正確的是( )
A.向FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- B.Ba(OH)2溶液與硫酸反應:OH-+H+=H2O C.向Al(OH)3沉淀中滴加鹽酸:Al(OH)3+3H+=Al3++3H2O D.向AlCl3溶液中加入過量氨水:Al3++4OH-=AlO2-+2H2O 組卷:6引用:3難度:0.7 -
3.常溫下溶液可發生如下反應
①16H++10Cl-+2MnO4-═2Mn2++5Cl2↑+8H2O
②2Fe2++Br2═2Fe3++2Br-
③2Br-+Cl2═Br2+2Cl-
由此判斷下列說法錯誤的是( )A.反應Cl2+2Fe2+═2Fe3++2Cl-可以進行 B.Cl元素在①③反應中均被還原 C.氧化性由強到弱的順序是MnO4-、Cl2、Br2、Fe3+ D.還原性由強到弱的順序是Fe2+、Br-、Cl-、Mn2+ 組卷:270引用:2難度:0.5 -
4.下列說法中,正確的是( )
A.鋁箔在酒精燈火焰上加熱熔化但不滴落,說明鋁箔表面氧化鋁膜的熔點高于鋁 B.向氫氧化鐵膠體中加入少量稀硫酸,因發生化學反應而產生紅褐色沉淀 C.置換反應不一定都是氧化還原反應 D.標況下,NA個SO2分子和NA個SO3分子體積相同(NA表示阿伏加德羅常數值) 組卷:34引用:2難度:0.7 -
5.下列排序不正確的是( )
A.穩定性 PH3<H2S<HCl B.沸點高低 NH3<PH3<AsH3 C.還原性 Br-<Fe2+<I- D.微粒半徑 K+<Cl ̄<S2 ̄ 組卷:14引用:3難度:0.9 -
6.下列操作不能用于檢驗NH3的是( )
A.氣體使酚酞試液變紅 B.氣體能使濕潤的紅色石蕊試紙變藍 C.氣體與蘸有濃H2SO4的玻璃棒靠近 D.氣體與蘸有濃鹽酸的玻璃棒靠近 組卷:111引用:4難度:0.9 -
7.對于下列事實的解釋不正確的是( )
A.在蔗糖中加入濃硫酸后出現發黑現象,說明濃硫酸具有脫水性 B.濃硝酸在光照下顏色變黃,說明濃硝酸不穩定 C.常溫下,濃硝酸可以用鋁罐貯存,說明鋁與濃硝酸不反應 D.氨氣可以完成噴泉實驗,說明氨氣極易溶于水 組卷:64引用:6難度:0.7
五、流程題(本大題共2小題,共13.0分)
-
21.某班同學用如下實驗探究Fe2+、Fe3+的性質。回答下列問題:
(1)分別取一定量氯化鐵、氯化亞鐵固體,均配制成0.1mol/L 的溶液。在FeCl2溶液中需加入少量鐵屑,其目的是。
(2)甲組同學取2mLFeCl2溶液,加入幾滴氯水,再加入1滴KSCN溶液,溶液變紅,說明Cl2可將Fe2+氧化。FeCl2溶液與氯水反應的離子方程式為。
(3)乙組同學認為甲組的實驗不夠嚴謹,該組同學在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入幾滴氯水和1滴KSCN溶液,溶液變紅,煤油的作用是。組卷:16引用:3難度:0.6 -
22.鋁土礦(主要成分為Al2O3,還含有SiO2、Fe2O3)是工業上制備氧化鋁的主要原料。工業上提取氧化鋁的工藝流程如圖。
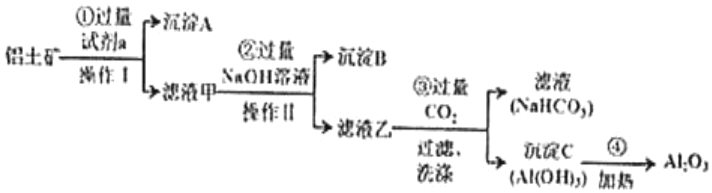
(1)沉淀A的成分是。(填化學式)
(2)步驟②中加入過量 NaOH 溶液發生反應的離子方程式,除了H++OH-═H2O;Fe3++3OH-═Fe(OH)3↓還有。
(3)步驟③中通入過量CO2氣體的離子方程式有。
(4)工業上制取AlCl3用Al2O3與C、Cl2在高溫條件下反應,每轉移1mol電子,消耗6g碳單質,反應的化學方程式為。組卷:12引用:1難度:0.4


