2021年河北省衡水市武邑中學高考化學七模試卷
發布:2024/4/20 14:35:0
一.選擇題(本題共9小題,每小題3分,共27分。在每小題給出的四個選項中,只有一項是符合題目要求的。)
-
1.化學與科技、社會、生產密切相關,下列說法正確的是( )
A.食品包裝袋中硅膠當呈現藍色時,還可以繼續做干燥劑 B.在石英管中充入氖氣,通電時能發出比熒光燈強億萬倍的強光,人稱“人造小太陽” C.衡水老白干用小麥釀酒的原理是通過蒸餾法將小麥中的乙醇分離出來 D.五彩繽紛的煙火是加入銅、鐵、鈉等金屬及其化合物 組卷:28引用:2難度:0.6 -
2.已知在常溫條件下,下列說法正確的是( )
A.水電離的c(H+)=10-7mol/L的溶液一定呈中性 B.將10mL 0.01mol/L NaOH溶液與同濃度的HA溶液混合,若混合后溶液呈中性,則消耗的HA的體積V≥10mL C.將1mL pH=8的NaOH溶液加水稀釋為100mL,pH下降兩個單位 D.若NH4Cl溶液和NH4HSO4溶液的pH相等,則c(NH4+)也相等 組卷:29引用:3難度:0.6 -
3.NA為阿伏加德羅常數,下列說法不正確的是( )
A.78g等物質的量混合的苯(C6H6)和苯乙烯(C8H8)的混合物中含有的碳氫鍵數為7NA B.H2O2+8H++2LiFePO4═2Fe3++2H2O+2H3PO4+2Li+,則每生成1mol Li+轉移的電子數為NA C.將0.1mol Cl2完全溶于水中,所得溶液中Cl2、Cl-、HClO、ClO-的粒子數之和小于0.2NA D.1L 1mol/L的NH4Br溶液中通入適量氨氣呈中性,此時溶液中NH4+的數目為NA 組卷:47引用:1難度:0.6 -
4.下列離子方程式的書寫及評價均合理的是( )
選項 離子方程式 評價 A 將2molCl2通入到含1molFeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2, 正確;Cl2過量,可將Fe2+、I-均氧化 B Mg(HCO3)2溶液與足量的NaOH溶液反應:Mg2++HCO3-+OH-=MgCO3↓+H2O 正確;酸式鹽與堿反應生成正鹽和水 C 過量SO2通入到NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- 正確;說明酸性:H2SO3強于HClO D 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等體積互相均勻混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O 正確;AlO2-與Al(OH)3消耗的H+的物質的量之比為2:3 A.A B.B C.C D.D 組卷:96引用:13難度:0.7 -
5.高分子修飾指對高聚物進行處理,接上不同取代基改變其性能。我國高分子科學家對聚乙烯進行胺化修飾,并進一步制備新材料,合成路線如圖。下列說法正確的是( )

A.a分子的核磁共振氫譜有4組峰 B.生成高分子b的反應為加聚反應 C.高分子c的水溶性比聚乙烯的水溶性好 D.1mol高分子b最多可與2mol NaOH反應 組卷:52引用:2難度:0.5 -
6.已知A、B、C、D、E、F為原子序數依次增大的短周期主族元素,A、D同主族,C、E同主族,A和B、F均能形成二元共價化合物,B元素與酸雨的形成有關。下列說法正確的是( )
A.離子半徑最大的元素為F B.氣態簡單氫化物的穩定性C<F C.簡單氫化物的沸點E>C D.D元素和A、B、C、E、F均能形成離子化合物 組卷:51引用:3難度:0.5
【化學一選修3:物質結構與性質】
-
17.由IIA元素與VA元素及副族所形成的化合物種類繁多,它們是探測器、激光器、微波器的重要材料。回答下列問題:
(1)基態Sc原子核外電子排布式為[Ar]。
(2)氧原子價電子層上的電子可以進行重排以便提供一個空軌道與氮原子形成配位鍵,該氧原子重排后的價電子排布圖為,電子重排后的氧原子能量有所升高,原因是不符合。(填“泡利原理”或“洪特規則”)
(3)自然界中不存在單質硼,硼的氫化物也很少,主要存在的是硼的含氧化合物,根據下表數據分析其原因是。
(4)比較大小:鍵角PH3化學鍵 B-H B-O B-B 鍵能(kJ?mol-1) 389 561 293 NH3(填“>”或“<”,下同);熔、沸點:PH3NH3。
(5)如圖1為四硼酸根離子球棍模型,該離子符號為,其中硼原子軌道的雜化類型有。
(6)疊氮酸銨(NH4N3)是一種具有爆炸性的無色晶體。疊氮酸根(N3-)的空間結構為;疊氮酸銨的晶胞如圖2所示,其晶胞參數為anm和0.5anm,阿伏加德羅常數的值為NA,NH4N3的密度為g?cm-3組卷:29引用:1難度:0.5
【化學一選修5:有機化學基礎】
-
18.研究結果表明,阿比朵爾具有免疫調節作用和干擾素誘導作用,2月4日李蘭娟院士團隊公布最新研究成果,阿比朵爾是抗擊新型冠狀病毒的潛在用藥。阿比朵爾(G)合成路線如圖所示。
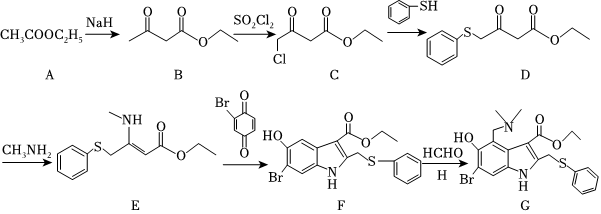
(1)A的名稱是,C中官能團的名稱為。
(2)C→D的反應類型為,由D生成E的化學方程式為。
(3)寫出同時符合下列條件的B的同分異構體有種(不考慮立體異構),其中核磁共振氫譜呈現4個吸收峰的異構體的結構簡式為。
①能與飽和碳酸氫鈉溶液反應產生使澄清石灰水變渾濁的氣體;
②六元環狀結構。
(4)H的結構簡式為。
(5)結合上述合成路線,設計出以乙醇和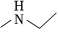 為原料(其他無機試劑任選),合成
為原料(其他無機試劑任選),合成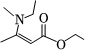 的路線(不超過4步) 。組卷:13引用:4難度:0.5
的路線(不超過4步) 。組卷:13引用:4難度:0.5


