2021-2022學年北京五十五中高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有1個選項符合題意)
-
1.中華民族的發(fā)明創(chuàng)造為人類文明進步做出了巨大貢獻,下列過程主要是利用化學反應中能量變化的是( )
A B C D 
神十一載人飛船發(fā)射
糧食釀醋
濕法煉銅
打磨磁石制司南A.A B.B C.C D.D 組卷:4引用:6難度:0.8 -
2.下列說法不正確的是( )
A.非自發(fā)反應就是不可能發(fā)生的反應,自發(fā)反應就是能較快進行的反應 B.反應NH3(g)+HCl(g)═NH4Cl(s)在低溫下能自發(fā)進行,說明該反應的△H<0 C.反應的限度越大,說明平衡時產物所占比例越高 D.若溫度改變,則可逆反應的平衡常數一定改變 組卷:17引用:5難度:0.5 -
3.25℃時,水的電離達到平衡:H2O?H++OH-。下列敘述正確的是( )
A.向水中加入稀氨水,平衡正向移動 B.向水中加入少量固體NaHSO4,平衡逆向移動 C.向水中加入少量NH4Cl固體,Kw增大 D.將水加熱至90℃,平衡逆向移動 組卷:54引用:2難度:0.9 -
4.下列方法中,可以使0.10 mol/L CH3COOH溶液中CH3COOH電離程度減小的是( )
A.升溫 B.加水稀釋 C.加入少量氯化鈉固體 D.加入少量醋酸鈉固體 組卷:110引用:5難度:0.8 -
5.常溫下,與0.01mol/LNaOH溶液的pH相同的溶液是( )
A.0.01mol/L鹽酸 B.0.01mol/LBa(OH)2溶液 C.pH=12的NaCN溶液 D.0.01mol/L氨水 組卷:111引用:5難度:0.6 -
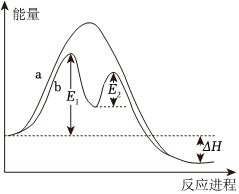 6.已知:2SO2(g)+O2(g)?2SO3(g) ΔH,不同條件下反應過程能量變化如圖所示。下列說法中不正確的是( )
6.已知:2SO2(g)+O2(g)?2SO3(g) ΔH,不同條件下反應過程能量變化如圖所示。下列說法中不正確的是( )A.反應的ΔH<0 B.過程b使用了催化劑 C.使用催化劑不能提高活化分子百分數 D.過程b發(fā)生兩步反應,第一步為吸熱反應,且反應較慢 組卷:29引用:8難度:0.6
二、解答題(共5小題,滿分0分)
-
18.霧霾嚴重危害人類健康和生態(tài)環(huán)境,開發(fā)穩(wěn)定高效的脫硫脫硝工藝技術是國內外研究的熱點。研究表明,氮氧化物(NOx)和二氧化硫在形成霧霾時與大氣中的氨有關,其轉化關系如圖所示。

(1)NH4NO3溶液中的離子濃度由大到小順序是。
(2)SO2屬于酸性氧化物,將其通入NaOH溶液中,得到NaHSO3溶液。
①NaHSO3溶液呈酸性,其原因是。
②向pH=5的NaHSO3溶液中滴加一定濃度的CaCl2溶液,溶液中出現渾濁,pH降為2,用平衡移動原理解釋溶液pH降低的原因是。
(3)某同學用中和滴定法測定某燒堿樣品的純度,實驗步驟如下:
Ⅰ.配制待測液:稱量5.0g燒堿樣品(雜質不與硫酸反應),配成1000mL溶液;
Ⅱ.滴定:取20.00mL所配待測液,用0.05mol?L-1的H2SO4標準溶液進行滴定,達到滴定終點后,重復此操作兩次;記錄數據如下表:
計算燒堿樣品的純度是測定序號 待測溶液體積(mL) 所耗H2SO4標準溶液的體積/mL 滴定前 滴定后 1 20.00 0.50 20.78 2 20.00 1.20 21.32 3 20.00 1.30 21.50 (計算結果保留三位有效數字)。下列實驗操作,會使測定結果偏高的是。
A.酸式滴定管未潤洗就裝H2SO4標準溶液滴定
B.錐形瓶在蒸餾水洗凈后未用待測液潤洗
C.讀取H2SO4標準溶液讀數時,滴定前仰視,滴定到終點后俯視
D.滴定前酸式滴定管尖嘴處有氣泡未排除,滴定后氣泡消失組卷:5引用:2難度:0.6 -
19.某小組同學進行實驗研究FeCl3溶液和Na2S溶液的反應。
(1)0.1mol?L-1Na2S溶液的pH為12.5。用離子方程式表示其顯堿性的原因:;配制FeCl3溶液時,需要將FeCl3溶于鹽酸,請結合化學用語來解釋原因。
【實驗一】
已知:FeS、Fe2S3均為黑色固體,均能溶于鹽酸。H2S氣體有臭雞蛋氣味。
(2)實驗前,同學們預測,反應會生成紅褐色沉淀和臭雞蛋氣味氣體,寫出離子方程式。
實驗一后,同學們對黑色沉淀的成分提出兩種假設:i.Fe3+與S2-反應直接生成沉淀Fe2S3。ii.Fe3+被S2-還原,生成沉淀FeS和S。
甲同學進行如下實驗:
根據上述實驗現象和資料,甲得出結論:黑色沉淀是Fe2S3。操作 現象 取少量FeS固體,加入稀鹽酸 固體溶解,有臭雞蛋氣味氣體生成 取少量Fe2S3固體,加入稀鹽酸 固體溶解,出現淡黃色渾濁,有臭雞蛋氣味氣體生成
(3)乙認為甲的結論不嚴謹,理由是。進一步研究證實,黑色沉淀的主要成分是Fe2S3。
【實驗二】
(4)進一步實驗證實,步驟Ⅰ中局部產生少量的黑色沉淀是Fe2S3,黑色沉淀溶解的主要原因不是Fe2S3與溶液中Fe3+發(fā)生氧化還原反應。步驟Ⅰ中黑色沉淀溶解的反應的離子方程式是步驟 操作 現象 Ⅰ 
開始時,局部產生少量的黑色沉淀,振蕩,黑色沉淀立即消失,同時溶液中產生淡黃色渾濁和臭雞蛋氣味的氣體 Ⅱ 繼續(xù)滴加入Na2S溶液 一段時間后,產生大量的黑色沉淀,振蕩,沉淀不消失 。
(5)根據以上研究,FeCl3溶液和Na2S溶液反應的產物與相關。組卷:8引用:3難度:0.7


