2017-2018學年甘肅省天水一中高二(下)入學化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共15小題,每小題4分,滿分60分)
-
1.下列物質中,不屬于醇的是( )
A. 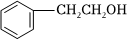
B. 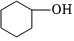
C. 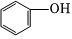
D.CH3OH 組卷:205引用:5難度:0.9 -
2.往水中加入下列物質,對水的電離平衡不產生影響的是( )
A.NaHSO4 B.CH3COOK C.KAl(SO4)2 D.NaI 組卷:48引用:6難度:0.9 -
3.自然界地表層原生銅的硫化物經氧化、淋濾作用后變成 CuSO4溶液,向地下層滲透,遇到難溶 的 ZnS 或 PbS,慢慢轉變為銅藍(CuS).下列分析正確的是( )
A.CuS 的溶解度大于 PbS 的溶解度 B.原生銅的硫化物具有還原性,而銅藍沒有還原性 C.CuSO4 與 ZnS 反應的離子方程式是 Cu2++S2-→CuS↓ D.整個過程涉及的反應類型有氧化還原反應和復分解反應 組卷:66引用:3難度:0.9 -
4.已知0.1mol/L的碳酸氫鈉溶液的pH為8.4,則下列說法正確的是( )
A.加入少量NaOH固體,鈉離子和碳酸根離子濃度均增大 B.將該溶液加水稀釋, 的比值保持不變c(Na+)c(HCO3-)C.c(Na+)+c(H+)=c(HCO3- )+c(CO32-)+c(OH-) D.c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) 組卷:42引用:8難度:0.7 -
5.5個碳的烷烴的同分異構體共有( )
A.1種 B.2種 C.3種 D.4種 組卷:13引用:3難度:0.9 -
6.甲烷是一種高效清潔的新能源,4g甲烷完全燃燒生成液態水時放出222.5kJ熱量,則下列熱化學方程式中表示甲烷燃燒熱的熱化學方程式是( )
A. CH4(g)+O2(g)═12CO2(g)+H2O(l)△H=+445 kJ?mol-112B.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890 kJ?mol-1 C.CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890 kJ?mol-1 D.2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=-1780 kJ?mol-1 組卷:105引用:5難度:0.8
二、解答題(共3小題,滿分0分)
-
17.請你利用所學的化學反應原理解決下列問題:
(1)下列溶液在空氣中加熱蒸干,并且灼燒之后,所得固體仍為原溶液中的溶質的是。
A.FeCl3 B.NaClO C.Fe2(SO4)3 D.K2SO3
(2)焙制糕點把NaHCO3作為發酵粉使用,往往添加少量的明礬,就是利用明礬中的Al3+與HCO3-發生雙水解,寫出離子方程式。
(3)常溫下,有0.1mol/L的鹽酸,由水電離出的c(H+)=,該鹽酸與0.04mol/L的Ba(OH)2等體積混合,混合后的pH值為。
(4)常溫下,物質的量濃度均為0.1 mol?L-1的下列溶液:
①Na2CO3溶液 ②NaOH溶液 ③CH3COONa溶液 ④NH4Cl溶液 ⑤NaNO3,溶液的pH由大到小的排列順序是。
(5)實驗:①0.1mol?L-1 AgNO3溶液和0.1mol?L-1NaCl溶液等體積混合得到濁液a,過濾得到濾液b和白色沉淀c;②向濾液b中滴加0.1mol?L-1 KI溶液,出現渾濁;③向沉淀c中滴加0.1mol?L-1KI溶液,沉淀變為黃色。
A.寫出AgCl沉淀溶解平衡方程式。
B.③中顏色變化說明Ksp(AgCl)Ksp(AgI)(填“>”、“<”、“=”)。組卷:6引用:1難度:0.7 -
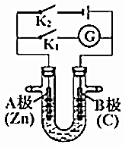 18.如圖所示,U形管內盛有100mL的溶液,按要求回答下列問題:
18.如圖所示,U形管內盛有100mL的溶液,按要求回答下列問題:
(1)斷開K2,閉合K1,若所盛溶液為AgNO3溶液:則A為極,B(石墨)極的電極反應式為。若所盛溶液為海水:則B極的電極反應式為
(2)斷開K1,閉合K2,若所盛溶液為滴有酚酞的NaCl溶液,則:
A電極附近可觀察到的現象是,
檢驗B電極上產生的物質的方法,
該裝置中發生的反應化學方程式是。組卷:0引用:1難度:0.7


