2022年江蘇省鹽城中學中考化學三模試卷(二)
發布:2024/12/31 17:30:3
一、選擇題
-
1.化學與生活密切相關。下列說法錯誤的是( )
A.圖書檔案失火用液態二氧化碳滅火器撲滅 B.推廣應用新材料改善人類的生活質量 C.大量使用農藥化肥促進農作物增產豐收 D.將鉛筆芯的粉末加入鎖芯,使鎖的開啟變得靈活 組卷:24引用:1難度:0.5 -
2.下列實驗操作正確的是( )
A. 
稱固體NaOHB. 
液體讀數C. 
過濾D. 
稀釋濃硫酸組卷:6引用:1難度:0.5 -
3.金屬釩被譽為“合金的維生素”.五氧化二釩(V2O5)中釩元素的化合價為( )
A.-3 B.+1 C.+3 D.+5 組卷:155引用:83難度:0.9 -
4.2021年,科學家創造出了目前世界上最輕的鎂原子(該鎂原子核內含有6個中子)。下列有關最輕鎂原子的說法錯誤的是( )
A.與普通的鎂原子所含質子數不同 B.形成的鎂離子結構示意圖為 
C.該原子對應的元素位于元素周期表第三周期 D.相對原子質量為18 組卷:66引用:1難度:0.7 -
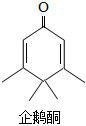 5.“企鵝酮”(C10H14O)因分子結構類似企鵝而得名。下列關于“企鵝酮”說法正確的是( )
5.“企鵝酮”(C10H14O)因分子結構類似企鵝而得名。下列關于“企鵝酮”說法正確的是( )A.由10個碳原子、14個氫原子和1個氧原子構成 B.屬于氧化物 C.相對分子質量為150g D.氫元素的質量分數最小 組卷:63引用:3難度:0.5
二、非選擇題
-
18.氧氣在冶煉工藝、化學工業、國防工業、醫療保健等方面有著十分重要的作用。
(1)工業制氧
膜分離制氧:在一定壓力下,讓空氣通過具有富集氧氣功能的薄膜,可得到含氧量較高的富氧空氣(含90%以上氧氣)。富氧空氣支持燃燒,能起到節能、環保的作用。
①富氧空氣比普通空氣更節能的原因是。
②關于富氧空氣以下說法正確的是(填字母)。
A.富氧空氣是純凈物
B.磷在富氧空氣中燃燒,產生大量白霧
C.硫在富氧空氣中燃燒,發出明亮藍紫色火焰
D.富氧空氣壓縮后體積變小是因為分子變小了
(2)生活制氧
①運輸活魚時,用過氧化鈣(CaO2)與水生成氧氣來增加水中含氧量,試推測過氧化鈣與水反應的生成物可能為(填字母)。
A.氫氧化鈣和氧氣
B.碳酸鈣和氧氣
C.氧化鈣和氧氣
②家庭便攜式制氧儀也可方便制氧。已知:到達肺部氧濃度=21%+4×氧流量(L/min)%,公式中的“21%”指的是病患吸氧時同時吸入的空氣中的的濃度,某重病患者應使用4L/min的氧流量,到達肺部的氧濃度是。
(3)航天器中制氧
航天器中宇航員的呼吸保障系統原理如圖所示。
①該呼吸保障系統中可循環利用的物質是。
②我國科學家對Sabatier系統中催化劑進行了研究。
在15MPa,催化劑質量相同,氣體流速為20mL/min時研究溫度對催化劑催化性能的影響,得到CO2的轉化率(%)如表:
分析上表數據可知:實驗分組 第1組 第2組 催化劑 Co4N/Al2O3 Co/Al2O3 溫度/℃ 300 320 340 360 300 320 340 360 CO2轉化率(%) 84.4 85.3 86.8 90.1 37.6 48.8 54.9 59.8 的催化性能更好(填字母)。
A.Co4N/Al2O3
B.Co/Al2O3
③一種新的循環利用方案是Bosch反應代替Sabatier反應。Bosch反應中CO2和H2生成了C和H2O,從原子利用率的角度來看,相比Sabatier反應,Bosch反應的優點是。組卷:43引用:1難度:0.5 -
19.鐵及其化合物在生活生產中應用非常廣泛。某興趣小組的同學對于碳酸亞鐵的制取和相關性質進行探究。
【查閱資料】
①溶液pH大于8.8時,Fe2+可完全轉化為Fe(OH)2沉淀。
②FeCO3是白色固體,難溶于水,遇氧氣、水會發生反應,生成Fe(OH)3;遇酸也會發生反應。
③FeCl3溶液中滴加KSCN溶液,溶液會變為血紅色;而FeCl2溶液中滴加KSCN溶液,溶液不變色。
④堿石灰的主要成分是NaOH和CaO。
【進行實驗】
(一)制取FeCO3
(1)某同學將生銹的鐵釘放入稀硫酸中除銹,除銹的化學方程式為。
(2)將除盡鐵銹后的鐵釘再放入足量的稀硫酸中,充分反應后發現溶液中有少量黑色固體出現,說明除銹后的鐵釘屬于(選填“純金屬”或“合金”)。
(3)用(2)中反應生成的溶液和pH=11.9的Na2CO3溶液反應制取FeCO3時,可能制得FeCO3的操作是(填字母)。
A.將少量的FeSO4溶液與大量的Na2CO3溶液同時加入到燒杯中,邊加邊攪拌
B.先將Na2CO3溶液加入燒杯中,再緩慢加入FeSO4溶液,邊加邊攪拌
C.先將FeSO4溶液加入燒杯中,再緩慢加入Na2CO3溶液,邊加邊攪拌
(4)碳酸亞鐵中的鐵元素可以幫助人們治療(選填“貧血”或“甲狀腺腫大”)。
(二)探究久置于潮濕空氣中FeCO3的成分。
【提出猜想】猜想一:FeCO3;猜想二:;猜想三:FeCO3和Fe(OH)3。
實驗I:
(1)取少量久置于潮濕空氣中的FeCO3固體于試管中,加入足量的稀鹽酸,觀察到試管內,說明該固體中含有FeCO3。
(2)取少量(1)反應后的溶液于試管中,進行了下一步實驗操作,該操作是,可觀察到,說明猜想三成立。
實驗Ⅱ:
該興趣小組為進一步確定固體中FeCO3的質量分數,稱取10.0g固體做了如圖所示的補充實驗。
(3)裝置A中分液漏斗里盛放的溶液為(填字母)。
A.濃鹽酸
B.稀硫酸
(4)反應結束后,需繼續通入一段時間N2,其目的是。
(5)實驗結束后,測得裝置C和D共增重1.1g,則固體中FeCO3的質量分數為。
(6)實驗過程中,若無E裝置,會使實驗結果(選填“偏大”、“偏小”或“不變”)。
【實驗結論】碳酸亞鐵在潮濕的空氣中易變質,故需要保存。組卷:80引用:2難度:0.6


