2022-2023學年四川省成都七中九年級(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題包括16個小題,每小題3分,共48分。每小題只有一個項符合題意)
-
1.下列具有“老濟南記憶”的民間技藝中,主要涉及到化學變化的是( )
A. 
民間剪紙B. 
捏制糖人C. 
雕刻蛋殼D. 
燒制黑陶組卷:24引用:3難度:0.9 -
2.下列實驗操作正確的是( )
A. 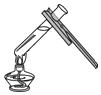
加熱液體B. 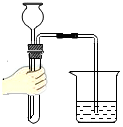
檢查氣密性C. 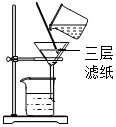
過濾懸濁液D. 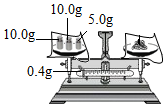
稱取25.4 g某固體藥品組卷:68引用:9難度:0.7 -
3.空氣是一種寶貴的資源,下列說法錯誤的是( )
A.空氣中氮氣的質(zhì)量分數(shù)約為78% B.能形成酸雨的空氣污染物主要是二氧化硫和二氧化氮 C.由于氦氣密度小和化學性質(zhì)很不活潑可將其充入氣飛艇 D.工業(yè)上用分離液態(tài)空氣的方法制氧氣利用了液氮和液氧的沸點不同 組卷:159引用:13難度:0.8 -
4.下列物質(zhì)的用途,主要由其化學性質(zhì)決定的是( )
A.銅絲用于制作導線 B.氧氣用于煉鋼 C.稀有氣體用作電光源 D.氮氣用于制造低溫環(huán)境 組卷:21引用:1難度:0.8 -
5.下列實驗現(xiàn)象的描述正確的是( )
A.燃著的蠟燭熄滅時產(chǎn)生白霧 B.鎂條在空氣中燃燒,發(fā)出耀眼白光,生成一種黑色固體 C.硫在空氣里燃燒發(fā)出微弱的淡藍色火焰,產(chǎn)生刺激性氣味氣體 D.細鐵絲在氧氣里燃燒,生成黑色四氧化三鐵固體 組卷:37引用:1難度:0.6 -
6.本杰明和戴維發(fā)明的“不對稱有機催化劑”使二人共同分享了2021年的諾貝爾化學獎,讓藥物、太陽能電池等的研發(fā)成本大幅降低,也更環(huán)保。下列說法正確的是( )
A.“不對稱有機催化劑”性價比高,對環(huán)境友好 B.沒有催化劑,化學反應(yīng)一定不能發(fā)生 C.氯酸鉀中加入催化劑可以更快地產(chǎn)生更多的氧氣 D.催化劑在化學反應(yīng)前后的質(zhì)量和性質(zhì)不會改變 組卷:86引用:3難度:0.5
四、流程及推斷(本題只有1個小題,共10分)
-
19.Ⅰ“溫控保鮮”和“氣調(diào)保鮮”是兩類食品保鮮技術(shù)。它們通過降低溫度和改變氣體成分,達到抑制儲藏物細胞呼吸的目的。如圖所示是工業(yè)上用膜分離技術(shù)實現(xiàn)“氣調(diào)保鮮”的流程。
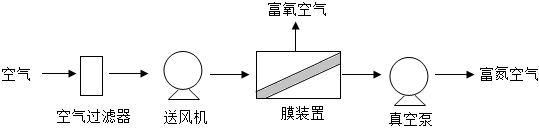
(1)冰箱中常用的是“氣調(diào)保鮮”,在空氣分離后,進入冰箱保鮮室內(nèi)的氣體(填“富氧空氣”或“富氮空氣”)。
(2)膜裝置內(nèi)發(fā)生的是(填“物理變化”或“化學變化”)。
(3)富氧空氣中氧氣和其他氣體的體積比可能是(填字母)。
A.1:3
B.1:4
C.1:5
D.1:6
Ⅱ.A一G是初中常見的7種物質(zhì)。它們有如圖所示的轉(zhuǎn)化關(guān)系。其中,“—”表示相連的兩種物質(zhì)能發(fā)生反應(yīng),“→”表示一種物質(zhì)能轉(zhuǎn)化成另一種物質(zhì)(反應(yīng)條件和部分反應(yīng)物已經(jīng)略去)。已知A和C是兩種組成元素相同的無色液體;B、G是無色氣體;E、F是黑色固體;水通電可以產(chǎn)生氧氣。請回答下列問題: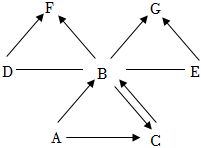
(1)請寫出下列物質(zhì)的化學式:D、E。
(2)A→B可用于。
(3)請寫出下列符號表達式:
①B→F,反應(yīng)的基本類型為。
②G→B可以通過自然界常見的實現(xiàn)。
(4)鑒別A和C兩種無色液體的實驗方法為。組卷:70引用:1難度:0.5
五、實驗探究(本題只有1個小題,共14分)
-
20.化學興趣小組對利用過氧化氫溶液制取氧氣,進行了一次拓展探究型學習。
Ⅰ.探究改進裝置創(chuàng)新實驗:
(1)創(chuàng)新實驗小組,自制如圖1所示的實驗裝置,完成制取氧氣及其性質(zhì)的相關(guān)實驗。
①利用圖1中A裝置制氧氣,檢查其氣密性的方法。
②檢驗C中收集滿氧氣的方法是。
③C中收集滿氧氣后,打開彈簧夾K1、K4,關(guān)閉K2、K3,其中打開K1的目的是。
④點燃D中燃燒匙內(nèi)的紅磷后,立即伸入C裝置中并把塞子塞緊,觀察到紅磷燃燒,待紅磷熄滅、C裝置冷卻后,打開K3,觀察到的現(xiàn)象是。
Ⅱ.探究H2O2溶液的濃度對分解速率的影響
(2)反應(yīng)速率探究小組用如圖實驗裝置,分別用注射器加入不同濃度的H2O2溶液(見如表),并使用傳感器裝置分別測定生成O2的質(zhì)量(圓底燒瓶內(nèi)氣壓變化在安全范圍),繪制氧氣的質(zhì)量隨時間變化的曲線,如圖2所示。實驗編號 H2O2的質(zhì)量分數(shù)(%) H2O2溶液的體積(mL) 對應(yīng)曲線 Ⅰ 3.4 10.0 a Ⅱ 2.4 10.0 b Ⅲ 1.7 10.0 c(待繪制) 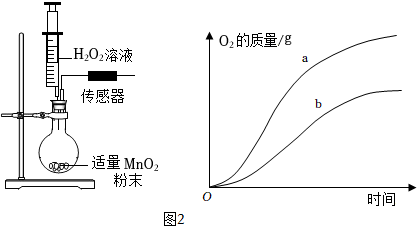
①根據(jù)實驗探究目的,從曲線a、b中,可得出的結(jié)論是。
②請畫出曲線c的大致位置及趨勢。
Ⅲ.探究H2O2溶液與84消毒液的反應(yīng)
(3)興趣小組的同學們在收拾整理時,不小心將84消毒液噴灑到了盛有H2O2溶液的廢液缸中,產(chǎn)生了許多氣泡。同學們沒有放過這次意外相遇,繼續(xù)進行了下面的探究。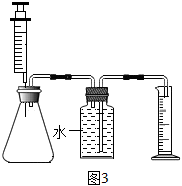
【查閱資料】84消毒液的有效成分是次氯酸鈉(化學式為NaClO)。
取少量84消毒液于試管中,滴加H2O2溶液,產(chǎn)生大量氣泡,實驗證明是氧氣。
【提出問題】在上述反應(yīng)中,NaClO的作用是什么?
【作出猜想】
猜想一:作反應(yīng)物,NaClO與H2O2溶液發(fā)生化學反應(yīng);
猜想二:作催化劑,類似H2O2溶液分解加入的MnO2的作用;
【進行實驗】
步驟1:按圖3所示組裝實驗裝置,并檢查裝置氣密性。
步驟2:向錐形瓶中加入30mL84消毒液,注射器中吸入25mLH2O2溶液。
步驟3:將注射器中的H2O2溶液平均分5次推入錐形瓶中:每次推入H2O2溶液,待不再產(chǎn)生氣泡后,記錄收集氣體的總體積(忽略其他因素對測量結(jié)果造成的影響)見如表。
①表中的數(shù)據(jù)x=第1次 第2次 第3次 第4次 第5次 收集氣體的總體積/mL 140 280 365 x 375 。
②分析表中數(shù)據(jù)得出“猜想一正確”,其依據(jù)是。
【分析討論】NaClO與H2O2溶液反應(yīng)除生成氧氣外,還生成氯化鈉和水。
③寫出該反應(yīng)的化學方程式。
【拓展反思】84消毒液、H2O2溶液是生活中常用消毒劑。除此外,還有75%酒精、過氧乙酸等。在使用各種消毒劑時,要考慮它們的性質(zhì)。切記:科學使用,注意安全!
④生活中下列使用消毒劑的做法正確的是(多選,填字母序號)。
A、不同的消毒劑可隨意混合使用
B、使用75%酒精消毒應(yīng)遠離明火,防止火災(zāi)
C、使用84消毒液的濃度越高越好
D、84消毒液、75%酒精等消毒劑均應(yīng)密封保存組卷:217引用:3難度:0.3


