2021-2022學年山東省日照市高二(上)期末化學試卷
發布:2024/4/20 14:35:0
一、選擇題:本題共10小題,每小題2分,共20分。每小題只有一個選項符合題意。
-
1.化學與生活息息相關。下列敘述錯誤的是( )
A.熱的碳酸鈉溶液可用于去除餐具的油污 B.明礬和二氧化氯均可作凈水劑,且凈水原理相同 C.農村推廣風力發電、光伏發電有利于“碳達峰、碳中和” D.電熱水器用鎂棒防止內膽腐蝕,采用的是犧牲陽極保護法 組卷:5引用:1難度:0.6 -
2.NCl3的水解反應方程式為:NCl3+H2O═HClO+NH3,下列說法正確的是( )
A.元素第一電離能:O>N B.氧原子的最高能級軌道形狀為球形 C.基態氯原子的價電子軌道表示式為: 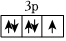
D.元素的電負性:O>Cl 組卷:26引用:2難度:0.7 -
3.下列過程中的化學反應,相應的離子方程式錯誤的是( )
A.氯化銅溶液中通入硫化氫:Cu2++S2-═CuS↓ B.惰性電極電解氯化鎂溶液:Mg2++2Cl-+2H2O Mg(OH)2↓+Cl2↑+H2↑通電C.向AgCl懸濁液中滴加Na2S溶液,白色沉淀變成黑色:2AgCl(s)+S2-(aq)═Ag2S(s)+2Cl-(aq) D.TiO2+水解析出TiO2?xH2O沉淀:TiO2++(x+1)H2O═TiO2?xH2O↓+2H+ 組卷:21引用:3難度:0.6 -
4.下列說法錯誤的是( )
A.碘單質的升華破壞的是范德華力 B.PCl5中心原子的價層電子對數為5 C.基態氯原子核外電子的運動狀態有17種 D.COCl2分子中單鍵-雙鍵的鍵角小于單鍵-單鍵的鍵角,是極性分子 組卷:12引用:1難度:0.6 -
5.一定溫度下發生反應:H2(g)+I2(g)?2HI(g) ΔH<0,達到平衡后,改變下列條件,可以使混合氣體顏色加深的是( )
A.縮小容器的容積 B.恒溫恒壓充入HI(g) C.降低溫度 D.恒溫恒容充入氦氣 組卷:76引用:1難度:0.8 -
6.設NA為阿伏加德羅常數的值,下列說法正確的是( )
A.常溫下,1LpH=10的純堿溶液中,由水電離產生的OH-數目為10-10NA B.0.1mol?L-1K2CO3溶液中CO32-數目小于0.1NA C.1L1mol?L-1氯化銨水溶液中NH4+與H+數目之和大于NA D.100mL0.1mol?L-1的NaOH水溶液中含有的氧原子數目為0.01NA 組卷:8引用:5難度:0.7
三、非選擇題:本題共5小題,共60分。
-
19.
 CuCl是一種難溶于水的白色固體,可用作有機合成的催化劑,在潮濕的空氣中易被氧化。實驗室常用CuCl2溶液與SOCl2制備CuCl,裝置如圖所示(夾持裝置省略)。
CuCl是一種難溶于水的白色固體,可用作有機合成的催化劑,在潮濕的空氣中易被氧化。實驗室常用CuCl2溶液與SOCl2制備CuCl,裝置如圖所示(夾持裝置省略)。
已知:SOCl2是一種無色易揮發液體,熔點-105℃,沸點79℃。
回答下列問題:
(1)盛裝氯化銅溶液的儀器名稱是。
(2)制備CuCl的離子方程式為。
(3)配制CuCl2溶液所需的蒸餾水需要煮沸,目的是。
(4)SOCl2遇水劇烈水解生成兩種酸性物質,其中一種能使品紅溶液褪色,寫出該水解反應的化學方程式:。
(5)冰水的作用是。
(6)產品CuCl純度測定。
稱取樣品0.25g置于預先放入50粒玻璃珠和10mL0.50mol?L-1FeCl3溶液的錐形瓶中,不斷搖動,待樣品完全溶解,加水50mL,鄰菲啰啉指示劑2滴,立即用0.10mol?L-1Ce(SO4)2標準溶液滴定至終點,消耗標準溶液25.51mL。同時做空白試驗一次,消耗Ce(SO4)2標準溶液0.53mL,如此再重復操作二次。0.25g樣品三次消耗Ce(SO4)2標準溶液平均體積為25.52mL,空白試驗三次消耗Ce(SO4)2標準溶液平均體積為0.52mL。測定過程涉及如下反應:CuCl+Fe3+═Cu2++Fe2++2Cl-、Fe2++Ce4+═Fe3++Ce3+,產品CuCl的純度為,若做空白試驗時,盛裝Ce(SO4)2標準液的滴定管未潤洗,則測得CuCl的純度(填“偏大”或“偏小”)。組卷:14引用:3難度:0.5 -
 20.氮氧化物的排放是造成大氣污染的原因之一,消除氮氧化物的污染對生態文明建設具有重要意義,回答下列問題:
20.氮氧化物的排放是造成大氣污染的原因之一,消除氮氧化物的污染對生態文明建設具有重要意義,回答下列問題:
(1)①N2(g)+O2(g)?2NO(g)ΔH=+180kJ?mol-1
②2CO(g)+O2(g)?2CO2(g)ΔH=-566kJ?mol-1
則相同條件下2CO(g)+2NO(g)?N2(g)+2CO2(g) ΔH=kJ?mol-1。
(2)一定溫度下,將2molCO、4molNO充入恒壓密閉容器中發生反應2CO(g)+2NO(g)?N2(g)+2CO2(g)。已知起始壓強為10MPa,10min時反應達到平衡狀態,測得N2的物質的量為0.5mol,則:
①0~10min內,平均反應速率v(N2)=MPa?min-1(保留2位小數)。
②此反應的平衡常數Kx=(Kx是以物質的量分數表示的平衡常數)。
③該條件下,可判斷此反應達到平衡狀態的標志是。
A.單位時間內,CO2斷裂2molC=O同時形成1molN≡N
B.混合氣體的平均相對分子質量不再改變
C.混合氣體的密度不再改變
D.CO與NO的轉化率比值不再改變
④若此時再向容器中充入0.2molCO(g)和0.4molNO(g),達到新平衡時NO的轉化率將(填“增大”“減小”或“不變”)。
(3)為探究溫度及不同催化劑對反應2NO(g)+2CO(g)?N2(g)+2CO2(g)的影響,保持其它初始條件不變,分別在不同催化劑(M、N)、不同溫度下,測得相同時間內NO轉化率與溫度的關系如圖所示,圖中c點對應的速率v正v逆(填“>”、“<”或“=”),其理由為。組卷:29引用:1難度:0.3


