2020-2021學(xué)年陜西省寶雞市渭濱區(qū)高二(下)期末化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題包括20小題,每題只有一個選項(xiàng)符合題意,每小題2.5分,共50分)
-
1.元素的性質(zhì)呈現(xiàn)周期性變化的根本原因是( )
A.原子半徑呈周期性變化 B.元素的化合價(jià)呈周期性變化 C.第一電離能呈周期性變化 D.元素原子的核外電子排布呈周期性變化 組卷:663引用:19難度:0.9 -
2.下列原子的電子排布圖中,符合能量最低原理的是( )
A. 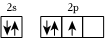
B. 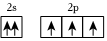
C. 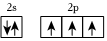
D. 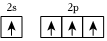 組卷:128引用:3難度:0.7
組卷:128引用:3難度:0.7 -
3.下列說法中正確的是( )
A.1s電子云呈球形,表示電子繞原子核做圓周運(yùn)動 B.電子云圖中的小黑點(diǎn)密度大,說明該原子核外空間電子數(shù)目多 C.ns能級的原子軌道圖可表示為如圖 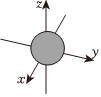
D.3d3表示3d能級有3個軌道 組卷:228引用:17難度:0.9 -
4.下列各組元素性質(zhì)的遞變情況錯誤的是( )
A.Li、Be、B原子的最外層電子數(shù)依次增多 B.P、S、Cl元素的最高正價(jià)依次升高 C.N、O、F元素的電負(fù)性依次增大 D.Na、K、Rb元素的第一電離能依次增大 組卷:24引用:13難度:0.7 -
5.下列事實(shí)與NH3極易溶于水無關(guān)的是( )
A.NH3與水反應(yīng)生成NH3?H2O B.NH3與水分子之間形成氫鍵 C.NH3和水分子的相對分子質(zhì)量接近 D.NH3是極性分子 組卷:97引用:7難度:0.7 -
6.下列現(xiàn)象與氫鍵有關(guān)的是( )
①NH3的熔、沸點(diǎn)比第ⅤA族相鄰元素的氫化物高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液態(tài)水的密度小
④尿素的熔、沸點(diǎn)比醋酸的高
⑤鄰羥基苯甲酸的熔、沸點(diǎn)比對羥基苯甲酸的低
⑥水分子高溫下也很穩(wěn)定A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③ 組卷:283引用:13難度:0.7 -
7.有關(guān)物質(zhì)結(jié)構(gòu)的下列說法中正確的是( )
A.碘升華時(shí)破壞了共價(jià)鍵 B.氯化鈉固體中的離子鍵在溶于水時(shí)被破壞 C.含極性鍵共價(jià)化合物一定是電解質(zhì) D.HF分子間作用力大于HCl,故HF比HCl穩(wěn)定 組卷:22引用:1難度:0.7 -
8.關(guān)于化學(xué)式[TiCl(H2O)5]Cl2?H2O的配合物的下列說法中正確的是( )
A.配位體是Cl-和H2O,配位數(shù)是9 B.中心離子是Ti4+,配離子是[TiCl(H2O)5]2+ C.內(nèi)界和外界中的Cl-的數(shù)目比是1:2 D.加入足量AgNO3溶液,所有Cl-均被完全沉淀 組卷:1323引用:59難度:0.5
二、填空題
-
23.如圖是元素周期表中的前四周期,①~⑨為相應(yīng)的元素,請從中選擇合適的元素回答問題:
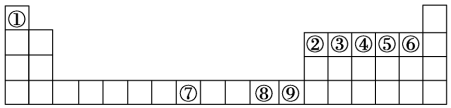
(1)根據(jù)元素原子的外圍電子排布特征,元素周期表可劃分為五個區(qū)域,①元素位于周期表的區(qū)。
(2)②、⑥兩元素形成的化合物的空間構(gòu)型為,其中心原子的雜化軌道類型為。
(3)寫出元素③與元素⑤形成的穩(wěn)定化合物的結(jié)構(gòu)式。
(4)⑧的二價(jià)陽離子與過量的④的氫化物的水化物作用的離子方程式為:。
(5)元素⑦與CO可形成X(CO)5型化合物,該化合物常溫下呈液態(tài),熔點(diǎn)為-20.5℃,沸點(diǎn)為103℃,易溶于非極性溶劑,據(jù)此可判斷該化合物晶體屬于晶體(填晶體類型)。
(6)元素⑨的離子的氫氧化物不溶于水,但可溶于氨水中,該離子與NH3間結(jié)合的作用力為。
(7)金屬⑦的晶體在不同溫度下有兩種堆積方式,晶胞分別如圖所示。則面心立方晶胞和體心立方晶胞中實(shí)際含有的原子個數(shù)之比為。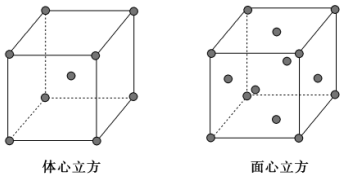 組卷:12引用:5難度:0.7
組卷:12引用:5難度:0.7 -
24.已知A-K是中學(xué)化學(xué)中常見有機(jī)物,其中G不能使酸性高錳酸鉀溶液褪色,它們之間有如下關(guān)系。試回答下列:
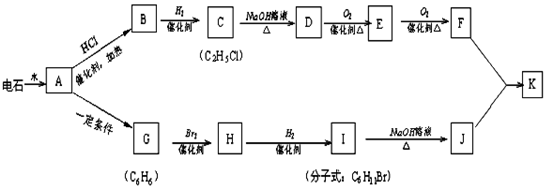
(1)寫出實(shí)驗(yàn)室制取A的化學(xué)方程式:;
(2)寫出D→E的化學(xué)方程式:;
(3)寫出反應(yīng)類型:C→D;H→I;
(4)寫出酯K的結(jié)構(gòu)簡式:。組卷:9引用:1難度:0.6


