2020-2021學年福建省福州高級中學高三(上)期中化學試卷
發布:2025/1/6 6:0:2
一、選擇題(本題包括10小題,每小題2分,共20分。每小題只有一個選項符合題意)
-
1.唐代詩人杜牧的《泊秦淮》中寫道“煙籠寒水月籠沙,夜泊秦淮近酒家。”下列說法錯誤的是( )
A.酒在人體內被還原,釋放能量 B.煙通常是膠體,其分散劑為空氣 C.沙中含SiO2,SiO2是制玻璃的原料之一 D.月球的土壤中吸附著百萬噸的氦(He-3),3為質量數 組卷:1引用:1難度:0.6 -
2.下列各組物質中,化學鍵類型不同的是( )
A.NaOH和NH4Cl B.H2O和NH3 C.MgF2和KBr D.CH4和Na2O 組卷:54引用:2難度:0.5 -
3.下列化學用語正確的是( )
A.NaCl的電子式: 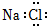
B.甲烷的結構式:CH4 C.硫離子的結構示意圖: 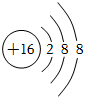
D.硫酸的電離方程式:H2SO4═H22++SO42- 組卷:11引用:3難度:0.7 -
4.催化還原CO2是解決溫室效應及能源問題的重要手段之一。研究表明,在Cu/ZnO催化劑存在下,CO2和H2可發生以下兩個平衡反應。下列有關說法不正確的是( )
①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ?mol-1
②CO2(g)+H2(g)?CO(g)+H2O(g)△H2=+41.2kJ?mol-1A.反應①為放熱反應,反應②為吸熱反應 B.使用不同催化劑,會改變反應①②的△H C.反應CO(g)+2H2(g)?CH3OH(g)的△H3=-94.9kJ?mol-1 D.投料比不變,增加反應物的濃度可提高CO2轉化為CH3OH平衡轉化率 組卷:90引用:3難度:0.5 -
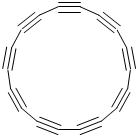 5.2019年8月《Science》雜志報道,化學家首次成功合成具有半導體特性的環狀C18分子(結構如圖),關于C18說法正確的是( )
5.2019年8月《Science》雜志報道,化學家首次成功合成具有半導體特性的環狀C18分子(結構如圖),關于C18說法正確的是( )A.與石墨互為同位素 B.屬于烴類 C.是原子晶體 D.能與氫氣在一定條件下反應 組卷:67引用:2難度:0.6 -
6.利用下列裝置(夾持裝置略)進行實驗,能達到實驗目的的是( )
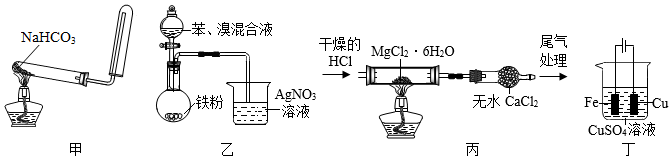
A.用甲裝置制備并收集CO2 B.用乙裝置制備溴苯并驗證有HBr產生 C.用丙裝置制備無水MgCl2 D.用丁裝置在鐵上鍍銅 組卷:714引用:21難度:0.5
三、非選擇題(包括第16題~第20題5個小題,共60分。)
-
19.Ⅰ.化學工業為疫情防控提供了強有力的物質支撐。N元素的許多化合物既是重要化工原料,又是高效、廣譜的滅菌消毒劑。一氯胺(NH2Cl)在中性或酸性環境中會發生強烈水解,生成具有強烈殺菌作用的HClO,是重要的水消毒劑。
(1)寫出NH2Cl的電子式: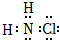 。
。
(2)寫出NH2Cl水解的化學方程式:。
Ⅱ.含氮材料為人類提供便利的同時,人類活動和工業化進程產生的N2O、NO和NO2等氮氧化物卻對空氣產生了巨大污染。可利用特種催化劑能使N2O分解。
(3)NO和NO2的處理。已除去N2O的硝酸尾氣可用NaOH溶液吸收,主要反應為:
NO+NO2+2OH-═2NO2-+H2O
2NO2+2OH-═NO2-+NO3-+H2O
①下列措施能提高尾氣中NO和NO2去除率的有(填字母)。
A.加快通入尾氣的速率
B.采用氣、液逆流的方式吸收尾氣
C.吸收尾氣過程中定期補加適量NaOH溶液
②吸收后的溶液經濃縮、結晶、過濾,得到NaNO2晶體,該晶體中的主要雜質是(化學式)。
(4)NO的氧化吸收:用NaClO溶液吸收硝酸尾氣,可提高尾氣中NO的去除率。其他條件相同,NO轉化為NO3-的轉化率隨NaClO溶液初始pH(用稀鹽酸調節)的變化如圖所示。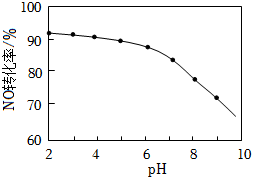
①在酸性NaClO溶液中,HClO氧化NO生成Cl-和NO3-,其離子方程式為。
②NaClO溶液的初始pH越小,NO轉化率越高。其原因是。組卷:9引用:1難度:0.5 -
20.H2O2是一種重要的化學品,其合成方法不斷發展。
(1)早期制備方法: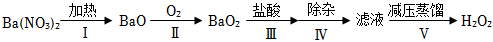
①Ⅰ為分解反應,產物除BaO、O2外,還有種紅棕色氣體。該物質是。
②Ⅱ為可逆反應,促進該反應正向進行的措施是。
③Ⅲ中生成H2O2,反應的化學方程式是。
④減壓能夠降低蒸餾溫度,從H2O2的化學性質角度說明Ⅴ中采用減壓蒸餾的原因:。
(2)電化學制備方法:已知反應2H2O2═2H2O+O2↑能自發進行,反向不能自發進行,通過電解可以實現由H2O和O2為原料制備H2O2,如圖為制備裝置示意圖。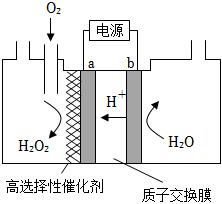
①a極的電極反應式是。
②下列說法正確的是。
A.該裝置可以實現電能轉化為化學能
B.電極b連接電源負極
C.該方法相較于早期制備方法具有原料廉價,對環境友好等優點組卷:5引用:3難度:0.5


