2020-2021學年北京市昌平區(qū)新學道臨川學校高二(上)期中化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題:本題共16個小題,每小題3分,共48分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列過程中,需要增大化學反應速率的是( )
A.鋼鐵腐蝕 B.食物腐敗 C.塑料老化 D.工業(yè)合成氨 組卷:74引用:36難度:0.7 -
2.分析下列反應在任何溫度下均能自發(fā)進行的是( )
A.2N2(g)+O2(g)═2N2O(g)ΔH=+163kJ?mol-1 B.Ag(s)+ Cl2(g)═AgCl(s)ΔH=-127kJ?mol-112C.HgO(s)═Hg(l)+ O2(g)ΔH=+91kJ?mol-112D.H2O2(l)═ O2(g)+H2O(l)ΔH=-98kJ?mol-112組卷:274引用:36難度:0.5 -
3.下列說法中,正確的是( )
A.化學反應速率是指一定時間內任何一種反應物的物質的量的減少或任何一種生成物物質的量的增加 B.化學反應速率為0.8mol?L-1?s-1是指1秒鐘時某物質的濃度為0.8mol?L-1 C.根據化學反應速率的大小可以知道化學反應進行的快慢 D.對于任何化學反應來說,反應速率越快,反應現象就越明顯 組卷:31引用:8難度:0.9 -
4.一定條件下,將A、B、C三種物質各1mol通入一個密閉容器中發(fā)生反應:2A+B?2C,達到化學反應限度時,B的物質的量可能是( )
A.1.5mol B.1mol C.0.5mol D.0 組卷:79引用:17難度:0.9 -
5.在一定溫度下,向a L密閉容器中加入1mol X氣體和2mol Y氣體,發(fā)生如下反應:X(g)+2Y(g)?2Z(g),此反應達到平衡的標志是( )
A.容器內氣體質量不隨時間變化 B.容器內各物質的濃度不隨時間變化 C.容器內混合氣體的密度不隨時間變化 D.單位時間內消耗0.1 mol X的同時生成0.2 mol Z 組卷:11引用:2難度:0.7 -
6.某研究小組研究了其他條件不變時,改變條件對可逆反應:2SO2(g)+O2(g)?2SO3(g)△H<0的影響。下列說法正確的是( )
A. 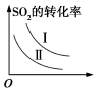
圖研究的是溫度、壓強對平衡的影響,橫軸表示壓強B. 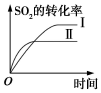
圖研究的是溫度對平衡的影響,Ⅱ采用的溫度更低C. 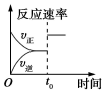
圖中t0時使用了催化劑,使平衡向正反應方向移動D. 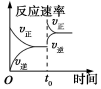
圖中t0時增大壓強,使平衡向正反應方向移動組卷:24引用:3難度:0.5 -
7.在一密閉容器中充入1mol H2和1mol I2,壓強為p(Pa),并在一定溫度下使其發(fā)生反應:H2(g)+I2(g)?2HI(g)△H<0.則下列敘述中不正確的是( )
A.保持容器容積不變,向其中再加入1mol H2,反應速率加快,理由是增大反應物氫氣的濃度,反應速率加快 B.保持容器內氣體壓強不變,向其中加入1mol N2(N2不參加反應),反應速率減慢,理由是保持壓強不變,向其中充入N2,體積變大,反應物濃度減小,反應速率減慢 C.保持容器容積不變,向其中加入1mol N2(N2不參加反應),反應速率不變,理由是反應物的濃度不變,反應速率不變 D.保持容器內氣體壓強不變,向其中再加入1mol H2(g)和1mol I2(g),反應速率減小,理由是容器體積變大反應物濃度變小,反應速率減小 組卷:21引用:2難度:0.7
二、非選擇題:本題包括5個小題,共52分。
-
20.為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖1甲、乙所示的實驗。請回答相關問題:
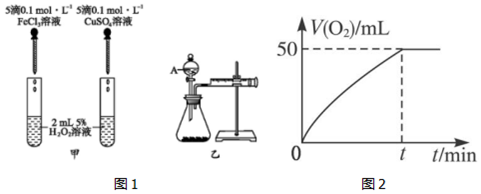
(1)定性比較:圖甲可通過觀察,定性比較得出結論。有同學提出將CuSO4改為CuCl2更合理,其理由是
(2)定量比較:如圖乙所示,實驗時均以生成40mL氣體為準,其他可能影響實驗的因素均已忽略。檢查該裝置氣密性的方法是,實驗中需要測量的數據是。
(3)將0.10mol MnO2粉末加入到50mL H2O2溶液中,在標準狀況下放出氣體的體積和時間的關系如圖2所示。
①寫出H2O2在MnO2作用下發(fā)生反應的化學方程式:。
②計算H2O2的初始物質的量濃度為。(請保留兩位有效數字)組卷:83引用:5難度:0.5 -
21.運用化學反應原理研究氮、硫等單質及其化合物的反應有重要意義。
(1)硫酸生產過程中2SO2(g)+O2(g)?2SO3(g),平衡混合體系中SO3的百分含量和溫度的關系如右圖所示,根據圖甲回答下列問題: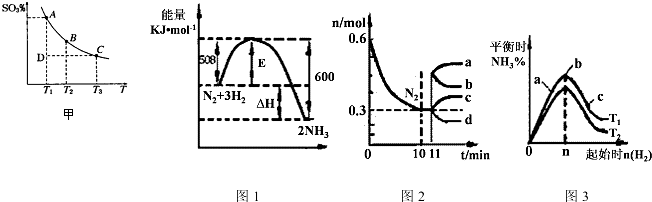
①2SO2(g)+O2(g)?2SO3(g)的△H0(填“>”或“<”),
②一定條件下,將SO2與O2以體積比2:1置于一體積不變的密閉容器中發(fā)生以上反應,能說明該反應已達到平衡的是。
a.體系的密度不發(fā)生變化
b.SO2與SO3的體積比保持不變
c.體系中硫元素的質量百分含量不再變化
d.單位時間內轉移4mol 電子,同時消耗2mol SO3
e.容器內的氣體分子總數不再變化
(2)一定的條件下,合成氨反應為:N2(g)+3H2(g)?2NH3(g)。圖1表示在此反應過程中的能量的變化,圖2表示在2L的密閉容器中反應時N2的物質的量隨時間的變化曲線。圖3表示在其他條件不變的情況下,改變起始物氫氣的物質的量對此反應平衡的影響。
①該反應的平衡常數表達式為,升高溫度,平衡常數(填“增大”或“減小”或“不變”)。
②由圖2信息,計算0~10min內該反應的平均速率v(H2)=,從11min起其它條件不變,壓縮容器的體積為1L,則n(N2)的變化曲線為(填“a”或“b”或“c”或“d”)
③圖3a、b、c三點所處的平衡狀態(tài)中,反應物N2的轉化率最高的是點,溫度T1T2(填“>”或“=”或“<”)組卷:37引用:6難度:0.5


