2020-2021學年內蒙古巴彥淖爾市杭錦后旗奮斗中學高二(上)期中化學試卷
發布:2024/4/20 14:35:0
一、選擇題(共22小題,每小題2分,滿分44分)
-
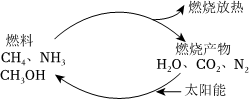 1.如果對燃燒產物如二氧化碳、水、氮氣等利用太陽能使它們重新組合,可以節約燃料,緩解能源危機。在此構想的物質循環中太陽能最終轉化為( )
1.如果對燃燒產物如二氧化碳、水、氮氣等利用太陽能使它們重新組合,可以節約燃料,緩解能源危機。在此構想的物質循環中太陽能最終轉化為( )A.化學能 B.熱能 C.生物質能 D.電能 組卷:13引用:3難度:0.9 -
2.下列措施是為了降低化學反應速率的是( )
A.食品放在冰箱中貯藏 B.工業煉鋼用純氧代替空氣 C.合成氨工業中使用催化劑 D.在加熱條件下,用氫氣還原氧化銅 組卷:20引用:11難度:0.9 -
 3.某反應由兩步反應A→B→C構成,它的反應能量曲線如圖,下列敘述正確的是( )
3.某反應由兩步反應A→B→C構成,它的反應能量曲線如圖,下列敘述正確的是( )A.兩步反應均為吸熱反應 B.A與C的能量差為E4 C.三種化合物中的穩定性B<A<C D.A→B反應,反應條件一定要加熱 組卷:118引用:6難度:0.8 -
4.在已經處于化學平衡狀態的體系中,如果下列量發生變化,其中一定能表明化學平衡移動的是( )
A.反應混合物的濃度 B.反應體系的壓強 C.正、逆反應的速率 D.反應物的轉化率 組卷:192引用:45難度:0.7 -
5.在一定溫度下的恒容密閉容器中,表明反應A(s)+2B(g)?C (g)+D(g)已達平衡的是( )
A.混合氣體的壓強不變 B.混合氣體的密度不變 C.反應物的相對分子質量不變 D.氣體的總物質的量不變 組卷:64引用:3難度:0.5 -
6.黑火藥是中國古代的四大發明之一,其爆炸的熱化學方程式為:
S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g)△H=xkJ?mol-1
已知:
碳的燃燒熱△H1=akJ?mol-1
S(s)+2K(s)═K2S(s)△H2=bkJ?mol-1
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=ckJ?mol-1
則x為( )A.3a+b-c B.c-3a-b C.a+b-c D.c-a-b 組卷:1156引用:107難度:0.9 -
7.體積一定的絕熱密閉容器中加入等物質的量的X、Y,進行如下可逆反應:X(g)+Y(g)?Z(g)+W(s)△H>0。下列敘述正確的是( )
A.若繼續充入X,平衡向正反應方向移動,Y的轉化率增大 B.若繼續充入Z,平衡逆向移動,Z的體積分數減小 C.若移走部分W,平衡正向移動 D.平衡后移走X,上述反應的△H減小 組卷:50引用:17難度:0.9 -
8.下列依據熱化學方程式得出的結論正確的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H═-57.3kJ?mol-1,則含40.0gNaOH的稀溶液與稀醋酸完全中和,放出的熱量小于57.3kJ B.已知2H2(g)+O2(g)=2H2O(g)△H═-483.6kJ?mol-1,則氫氣的燃燒熱為241.8kJ?mol-1 C.已知2C(s)+2O2(g)=2CO2(g)△H=a;2C(s)+O2(g)=2CO(g)△H=b,則a>b D.已知P4(白磷,s)=4P(紅磷,S)△H<0,則白磷比紅磷穩定 組卷:101引用:2難度:0.5
二、解答題(共4小題,滿分56分)
-
25.(1)2010年Sheth等得出乙炔在Pd表面選擇加氫的反應機理(如圖)。其中吸附在Pd表面上的物種用*標注。

上述吸附反應為(填“放熱”或“吸熱”)反應,該歷程中最大能壘(活化能)為kJ?mol-1,該步驟的化學方程式為。
(2)已知:Fe(s)+CO2(g)?FeO(s)+CO(g) ΔH1,平衡常數為K1;
Fe(s)+H2O(g)?FeO(s)+H2(g) ΔH2,平衡常數為K2。
在不同溫度時K1、K2的值如表:700℃ 900℃ K1 1.47 2.15 K2 2.38 1.67
反應CO2(g)+H2(g)?CO(g)+H2O(g) ΔH,平衡常數為K,則ΔH=(用ΔH1和ΔH2表示),K=(用K1和K2表示),且由上述計算可知,反應CO2(g)+H2(g)?CO(g)+H2O(g)是(填“吸熱”或“放熱”)反應。
(3)已知化學反應A2(g)+B2(g)═2AB(g)的能量變化如圖,請寫出該反應的熱化學方程式:。組卷:9引用:1難度:0.7 -
26.汽車尾氣已成為城市空氣的主要污染源之一,其中的氮氧化物是重要污染物。
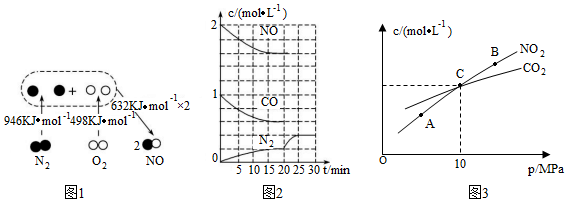
(1)汽車內燃機工作時產生NO的原理如圖1所示:該反應的熱化學方程式為。
(2)治理尾氣的方法之一是在排氣管上安裝催化轉化器,發生如下反應:2NO(g)+2CO(g)?N2(g)+2CO2(g) ΔH<0。若在一定溫度下將2 mol NO、1 mol CO充入1 L固定容積的容器中,反應過程中各物質的濃度變化如圖2所示。
①則從開始到達到平衡狀態的過程中,平均反應速率v(CO2)=,該溫度下反應的平衡常數K=。(結果保留兩位有效數字)
②20 min時改變的條件可能是。
A.增大壓強
B.降低溫度
C.減小CO2濃度且改用更高效的催化劑
D.在恒溫恒容條件下,充入He氣體
③若保持溫度不變,20 min時向容器中充入CO、N2各0.6 mol,平衡將(填“正向”“逆向”或“不”)移動,原因是。
(3)用焦炭還原NO2的反應為2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒溫條件下,向1 L密閉容器中加入不同物質的量的NO2和足量C發生該反應,測得平衡時NO2和CO2的物質的量濃度與平衡總壓強的關系如圖3所示,計算C點時該反應的平衡常數Kp(C)=(Kp是用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數)。組卷:5引用:1難度:0.5


