2018-2019學年江西省宜春市五校聯考高三(上)開學化學試卷
發布:2025/1/3 13:30:2
一、選擇題(共16小題,每小題3分,滿分48分)
-
1.化學與生活密切相關,下列敘述正確的是( )
A.石灰水噴涂在樹干上可以消滅樹皮上的過冬才蟲卵,是因為Ca(OH)2有毒,可毒死蟲卵 B.明礬和氯水是常用的水處理劑,常用于海水的淡化 C.侯德榜制堿法先通入NH3是為了增大CO2的溶解度 D.在食品袋中放入盛有CaCl2?6H2O和鐵粉透氣小袋,可防止食物受潮、氧化變質 組卷:6引用:2難度:0.8 -
2.設NA代表阿伏加德羅常數的數值,下列說法正確的是( )
A.1mol?L-1的NaClO溶液中含有ClO-的數目小于NA B.0.1mol H218O中所含中子總數為1.2NA C.在標準狀況下,2.8g N2和2.24L CO所含電子數均為1.4NA D.常溫下,5.6克鐵與足量的濃硫酸與反應,轉移電子數為0.3NA 組卷:6引用:1難度:0.6 -
3.化學與生活密切相關,下列說法正確的是( )
A.煮熟的雞蛋不能孵化成小雞原因是蛋白質變性 B.棉、麻、絲、毛完全燃燒后都只生成CO2和H2O C.氨基酸在人體中生成新的蛋白質屬于加聚反應 D.為加快漂白精的漂白速率,使用時可加少量的食鹽水 組卷:2引用:2難度:0.6 -
4.姜黃素有抗氧化、保肝護肝、抑制腫瘤生長等功能。它的結構簡式如圖所示
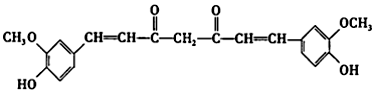
下列有關姜黃素的說法正確的是( )A.姜黃素在一定條件下能發生水解、加成、氧化反應 B.1個姜黃素分子一定有15個原子共平面 C.1mol姜黃素在鎳(Ni)、加熱條件下最多10 mol H2發生加成反應 D.姜黃素的分子式為C21H18O6 組卷:5引用:2難度:0.6 -
5.下列離子方程式不正確的是( )
A.Fe3O4與HI反應的離子方程式為:Fe3O4+8H++2I-═3Fe2++I2+4H2O B.用稀H2SO4除去銅綠:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++Al3++2SO42-+4OH-═AlO2-+2H2O+2BaSO4↓ D.少量Ca(OH)2溶液與NaHCO3混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- 組卷:5引用:1難度:0.6 -
6.下列關于有機物的說法不正確的是( )
A.等質量的乙烯和丙烯完全燃燒耗氧量相同 B.用碳酸鈉溶液可以區分乙醇、乙酸、苯和硝基苯四種有機物 C.丙烯分子中最多有8個原子共平面 D.有芳香氣味的C9Hl8O2在酸性條件下加熱可水解產生相對分子質量相同的兩種有機物,則符合此條件的C9H18O2的結構有16種 組卷:16引用:2難度:0.7 -
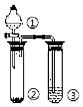 7.利用如圖所示裝置分別盛放相應物質進行下列實驗,得出結論正確的是( )
7.利用如圖所示裝置分別盛放相應物質進行下列實驗,得出結論正確的是( )選項 ① ② ③ 判定結論 A 濃硫酸 蔗糖 溴水 用來判定濃硫酸具有脫水性、氧化性 B 稀鹽酸 Na2SO3 Ba(NO3)2 用來判定SO2與可溶性鋇鹽均可生成白色沉淀 C 濃鹽酸 Na2CO3 Na2SiO3 用來判定酸性:鹽酸>碳酸>硅酸 D 濃硫酸 Cu NaOH 用來判定制備SO2并吸收尾氣 A.A B.B C.C D.D 組卷:5引用:1難度:0.6
二、解答題(共5小題,滿分52分)
-
20.硫酸鋅可作為食品鋅強化劑的原料。工業上常用菱鋅礦生產硫酸鋅,菱鋅礦的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生產工藝流程示意如下:
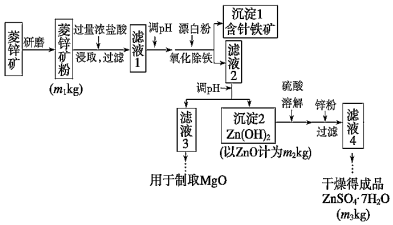
(1)完成“氧化除鐵”步驟中反應的離子方程式:
()Fe(OH)2+()+()═()Fe(OH)3+()Cl-
(2)針鐵礦(Coethite)是以德國詩人歌德(Coethe)名字命名的,組成元素是Fe、O和H,相對分子質量為89,化學式是。
(3)根據下表數據,調節“濾液2”的pH時,理論上可選用的最大區間為。
(4)工業上從“濾液3”制取MgO過程中,合適的反應物是Mg(OH)2 Zn(OH)2 MgCO3 CaCO3 開始沉淀的pH 10.4 6.4 - - 沉淀完全的pH 12.4 8.0 - - 開始溶解的pH - 10.5 - - Ksp mol3?L-3 5.6×10-12 - 6.8×10-10 2.8×10-9 (選填序號)。
a.大理石粉 b.石灰粉 c.純堿溶液 d.燒堿溶液
(5)分析圖中數據,菱鋅礦粉中ZnCO3的質量分數不低于。組卷:18引用:1難度:0.4 -
21.鹵代烴在醚類溶劑中與Mg反應可制得格氏試劑,格氏試劑在有機合成方面用途廣泛。設R為烴基,已知:
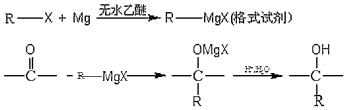
某有機物A有如下轉化關系: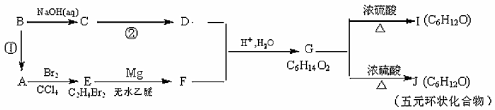
試回答下列問題:
(1)反應①的反應試劑和實驗條件是
(2)C→D的化學反應方程式為;
(3)G的結構簡式是,G的最簡單的同系物的名稱是
(4)I中所含官能團的名稱是
(5)能發生銀鏡反應的J的同分異構體有種。寫出其中含-CH3個數最多的異構體的結構簡式。組卷:3引用:1難度:0.4


