2021-2022學年黑龍江省大興安嶺地區(qū)呼瑪高級中學高二(上)期末化學試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(本題共16小題,每小題3分,共45分。每小題只有一個選項符合題意)
-
1.一定條件下,氫氣與氧氣反應(yīng)的能量變化如圖所示,下列說法中正確的是( )
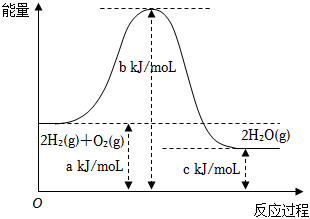
A.該反應(yīng)的反應(yīng)熱△H=(c-a)kJ/mol B.該反應(yīng)為吸熱反應(yīng) C.斷裂2molH-H和1molO=O放出(b-a)kJ的能量 D.H2燃燒熱的熱化學方程式為:H2(g)+ O2(g)═H2O(g)△H=12kJ/mol(c-a)2組卷:49引用:9難度:0.6 -
2.用H2O2和H2SO4的混合溶液可溶出廢舊印刷電路板上的銅。已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g) ΔH1=+64.39kJ?mol-1
②2H2O2(l)═2H2O(l)+O2(g) ΔH2=-196.46kJ?mol-1
③H2(g)+O2(g)═H2O(1)ΔH3=-285.84kJ?mol-112
在H2SO4溶液中,1molCu(s)與H2O2(l)反應(yīng)生成Cu2+(aq)和H2O(l)的反應(yīng)熱ΔH等于( )A.-319.68kJ?mol-1 B.-417.91kJ?mol-1 C.-448.46kJ?mol-1 D.+546.69kJ?mol-1 組卷:45引用:4難度:0.6 -
3.已知:①H2O(g)═H2O(l)ΔH1=-Q1kJ?mol-1(Q1>0)
②C2H5OH(g)═C2H5OH(l)ΔH2=-Q2kJ?mol-1(Q2>0)
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)ΔH3=-Q3kJ?mol-1(Q3>0)
若使23g液態(tài)乙醇完全燃燒,最后恢復到室溫,則放出的熱量(kJ)為( )A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3) C.1.5Q1-0.5Q2+0.5Q3 D.0.5Q1-1.5Q2+0.5Q3 組卷:13引用:1難度:0.7 -
4.下列有關(guān)說法正確的是( )
A.已知HI(g)? H2(g)+12I2(s) ΔH=-26.5kJ?mol-1,由此可知1molHI氣體在密閉容器中充分分解后可以放出26.5kJ的熱量12B.已知2H2(g)+O2(g)=2H2O(g) ΔH=-571.6kJ?mol-1,則氫氣的燃燒熱為ΔH=-285.8kJ?mol-1 C.已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,則ΔH1<ΔH2 D.含20.0gNaOH的稀溶液與稀鹽酸完全中和,放出28.7kJ的熱量,則稀醋酸和稀NaOH溶液反應(yīng)的熱化學方程式為:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH=-57.4kJ?mol-1 組卷:92引用:6難度:0.7 -
5.對反應(yīng)2A(g)+B(s)?3C(g)+4D(g)來說,下列反應(yīng)速率最快的是( )
A.v(A)=0.5mol?L-1?min-1 B.v(B)=0.05mol?L-1?s-1 C.v(C)=1.0mol?L-1?min-1 D.v(D)=1.0mol?L-1?min-1 組卷:28引用:2難度:0.5 -
6.一定溫度下,將1molA和2molB放入5L的密閉容器中發(fā)生如下反應(yīng):A(s)+2B(g)?C(g)+2D(g)△H<0,經(jīng)5min后,測得容器內(nèi)B的濃度減少了0.2mol/L。下列敘述正確的是( )
A.加入少量A,反應(yīng)速率加快 B.在5min內(nèi)該反應(yīng)用C的濃度改變量表示的反應(yīng)速率為0.02mol/(L?min) C.保持體積不變,向容器充入一定量氦氣,壓強增大,反應(yīng)速率加快 D.升高溫度,正反應(yīng)速率減小,逆反應(yīng)速率加快 組卷:4引用:2難度:0.7
二、非選擇題(本題共4小題,每空2分,共52分)
-
19.近年來,隨著聚酯工業(yè)的快速發(fā)展,氯氣的需求量和氯化氫的產(chǎn)出量也隨之迅速增長。因此,將氯化氫轉(zhuǎn)化為氯氣的技術(shù)成為科學研究的熱點。回答下列問題:
(1)Deacon發(fā)明的直接氧化法為:4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)。如圖為剛性容器中,進料濃度比c(HCl):c(O2)分別等于1:1、4:1、7:1時HCl平衡轉(zhuǎn)化率隨溫度變化的關(guān)系: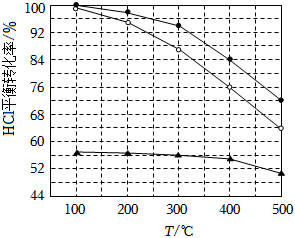
可知反應(yīng)平衡常數(shù)K(300℃)K(400℃)(填“大于”或“小于”)。設(shè)HCl初始濃度為c0,根據(jù)進料濃度比c(HCl):c(O2)=1:1的數(shù)據(jù)計算K(400℃)=(列出計算式)。
(2)Deacon直接氧化法可按下列催化過程進行:
CuCl2(s)═CuCl(s)+Cl2(g) ΔH1=83kJ?mol-112
CuCl(s)+O2(g)═CuO(s)+12Cl2(g) ΔH2=-20kJ?mol-112
CuO(s)+2HCl(g)═CuCl2(s)+H2O(g) ΔH3=-121kJ?mol-1
則4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)的ΔH=kJ?mol-1。
(3)在一定溫度的條件下,進一步提高HCl的轉(zhuǎn)化率的方法是。(寫出2種)
(4)在傳統(tǒng)的電解氯化氫回收氯氣技術(shù)的基礎(chǔ)上,科學家最近采用碳基電極材料設(shè)計了一種新的工藝方案,主要包括電化學過程和化學過程,如圖所示: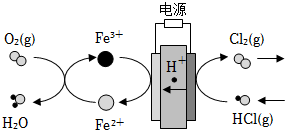
負極區(qū)發(fā)生的反應(yīng)有(寫反應(yīng)方程式)。電路中轉(zhuǎn)移1mol電子,需消耗氧氣L(標準狀況)。組卷:15引用:3難度:0.6 -
20.Ⅰ高純硫酸錳作為合成鎳鈷錳三元正極材料的原料,工業(yè)上可由天然二氧化錳粉與硫化錳礦(還含F(xiàn)e、Al、Mg、Zn、Ni、Si等元素)制備,工藝如下圖所示。回答下列問題:
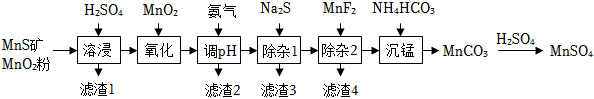
相關(guān)金屬離子[c0(Mn+)=0.1 mol?L-1]形成氫氧化物沉淀的pH范圍如下:
(1)“濾渣1”含有S和金屬離子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+ 開始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9 沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9 ;寫出“溶浸”中二氧化錳與硫化錳反應(yīng)的化學方程式。
(2)“氧化”中添加適量的MnO2的作用是將。
(3)“調(diào)pH”除鐵和鋁,溶液的pH范圍應(yīng)調(diào)節(jié)為~6之間。
(4)“除雜1”的目的是除去Zn2+和Ni2+,“濾渣3”的主要成分是。
(5)“除雜2”的目的是生成MgF2沉淀除去Mg2+.若溶液酸度過高,Mg2+沉淀不完全,原因是。
(6)寫出“沉錳”的離子方程式。組卷:83引用:4難度:0.5


