2022-2023學年北京師大附屬實驗中學高一(下)期中化學試卷
發布:2024/9/20 6:0:10
一、(選擇題共45分)
-
1.下列過程屬于人工固氮的是( )
A.工業合成氨 B.分離液態空氣制N2 C.閃電時N2轉化為NO D.豆科植物的根瘤菌將N2轉化為氨 組卷:72引用:6難度:0.9 -
2.常溫下,下列溶液可用鐵質容器盛裝的是( )
A.濃硝酸 B.稀硫酸 C.稀硝酸 D.稀鹽酸 組卷:261引用:14難度:0.5 -
3.下列金屬,在工業上常用電解法冶煉的是( )
A.銅 B.鋁 C.鐵 D.銀 組卷:23引用:2難度:0.8 -
4.下列物質中屬于含有共價鍵的強電解質的是( )
A.CH3COOH B.C2H5OH C.MgCl2 D.Na2SO4 組卷:86引用:2難度:0.8 -
5.取一支試管,收集半試管CH4和半試管Cl2,在光照下得到的取代產物是( )
①CH3Cl
②CH2Cl2
③CHCl3
④CCl4A.只有① B.只有④ C.①②③的混合物 D.①②③④的混合物 組卷:495引用:8難度:0.6 -
6.下列離子半徑最小的是( )
A.Mg2+ B.Al3+ C.O2- D.F- 組卷:117引用:2難度:0.8 -
7.某有機物的結構簡式為CH2=CHCH2CH2OH,不能與該有機物發生反應的物質有( )
A.Na B.H2 C.NaOH溶液 D.酸性KMnO4溶液 組卷:34引用:1難度:0.8
二、填空題(共55分)
-
20.鍺Ge及其化合物應用于航空航天測控、光纖通訊等領域、一種提純二氧化鍺粗品(主要含GeO2、As2O3)的工藝如圖:
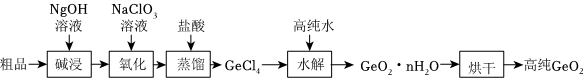
已知:ⅰ.Ge位于第四周期ⅣA族,GeO2為兩性氧化物,GeCl4沸點低.
ⅱ.As位于第四周期ⅤA族,As2O3為兩性氧化物,As2Cl3沸點低.
(1)寫出“堿浸”過程中GeO2發生反應的離子方程式.
(2)“氧化”過程是將Na3AsO3氧化為As的最高價的化合物.
①理論上消耗Na3AsO3與NaClO3的物質的量之比為.
②如果沒有“氧化”過程,產生的影響可能是.
(3)“水解”過程得到沉淀GeO2?nH3O,過濾,濾液經過處理后可用于過程,實現物質循環利用.組卷:34引用:1難度:0.5 -
21.某小組同學制備碘酸鹽(
)并探究其性質.IO-3
資料:①I2可與NaOH溶液反應生成和I-.IO-3
②碘酸鈣[Ca(IO3)2]為難溶于水、能溶于硝酸的白色固體.
③X2的氧化性,X-的還原性與溶液的酸堿性無關:與氧化性隨溶液酸性增強而增強(X為Cl、Br或I).IO-3
實驗裝置如圖(加熱與夾持裝置略):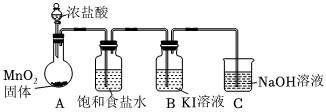
步驟:
Ⅰ.打開A中分液漏斗活塞,加熱固底燒瓶;一段時間后,B中溶液由無色變為棕黃色.
Ⅱ.將B中棕黃色溶液倒入燒杯中,再加入NaOH溶液,燒杯中溶液由棕黃色變為無色.
(1)A裝置發生的化學方程式為.
(2)C裝置發生的離子方程式為.
(3)取少量步驟Ⅱ后所得無色溶液,加入過量鹽酸和CCl4,振蕩后靜置,溶液分層,上層呈淺黃色,下層呈紫色.甲同學得出結論:在酸性條件下可以氧化I-為I2.IO-3
①乙同學認為上述結論不合理,可能原因如下:
原因一:空氣中O2在酸性條件下將溶液中的I-氧化,離子方程式為.
原因二:(填化學式)在酸性條件下將溶液中的I-氧化.
②為了進一步證明在酸性條件下可氧化I-為I2,完成如下實驗:IO-3
ⅰ.另取與(3)等量的步驟Ⅱ后所得無色溶液,加入稍過量CaCl2固體,振蕩,充分反應后過濾得到無色溶液X和沉淀Y.
ⅱ.向無色溶液X,加入與(3)等量的鹽酸和CCl4,振蕩后靜置,溶液分層,上、下層均幾乎無色.
ⅲ.取少量洗滌后的沉淀Y加入稀HNO3,固體溶解,繼續加入少量KI溶液,溶液呈黃色.
ⅳ.……
a.由實驗ⅰ、ⅱ得出結論:.
b.由實驗ⅲ和ⅳ得出結論:在酸性條件下可以氧化I-為I2.補全實驗ⅳ的操作和現象IO-3.
(4)根據實驗ⅲ得出:氧化性I2(填“>”或“<”),而實驗ⅰ表明I2和IO-3的氧化性強弱關系相反,原因是IO-3.
(5)查閱資料發現,與相應的X-(X=Cl,Br)均有類似上述反應.濃度相同時,氧化性XO-3≈ClO-3,但濃度均為0.1mol/L的BrO-3和Cl-開始發生反應時的pH為1,而濃度均為0.1mol/L的ClO-3和Br-開始發生反應的pH為5.試從原子結構的角度解釋兩個反應開始發生時pH不同的原因BrO-3.組卷:95引用:5難度:0.4


