魯教版九年級下冊《9.2 金屬的化學性質》2017年同步練習卷(4)
發布:2024/11/17 23:0:1
一、選擇題(共4小題,每小題3分,滿分12分)
-
1.我省明代科學家宋應星所著的《天工開物》中,詳細記述了金、銅、鐵、鋅等金屬的開采和冶煉方法,記述的金屬中金屬活動性最強的是( )
A.金 B.銅 C.鐵 D.鋅 組卷:352引用:24難度:0.9 -
2.下列金屬單質不能與稀鹽酸反應放出氫氣的是( )
A.Cu B.Zn C.Mg D.Fe 組卷:543引用:13難度:0.7 -
3.下列屬于置換反應的是( )
A.2H2O 2H2↑+O2↑通電B.H2+CuO Cu+H2O加熱C.S+O2 SO2點燃D.NaOH+HCl=NaCl+H2O 組卷:446引用:15難度:0.7 -
4.CCTV《鑒寶》欄目中的一位收藏家收藏的清末鋁制品,至今保持仍十分完好,該藝術品不易銹蝕的主要原因是( )
A.鋁不易發生化學反應 B.鋁的氧化物易發生還原反應 C.鋁不易氧化 D.鋁易被氧化,但鋁表面的氧化鋁具有保護內部鋁的作用 組卷:66引用:31難度:0.9
二、填空題(共1小題,每小題3分,滿分3分)
-
5.四支試管中分別盛有相同質量分數的稀鹽酸,將A、B、C和鋅四種金屬分別同時放入其中,小明將觀察到的現象形象的畫了一幅卡通畫,每個卡通人物表示一種金屬,周圍的小黑點表示反應中生成的氣體。
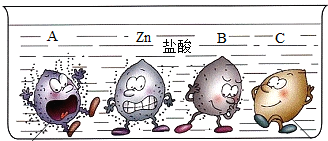
(1)A、B、C三種金屬的活潑性由強到弱的順序可能是。
(2)B是常見的金屬,請寫出該金屬和鹽酸反應的化學方程式。組卷:27引用:11難度:0.5
三、選擇題(共4小題,每小題3分,滿分12分)
-
6.某同學為了測定銅鎂合金樣品中銅的質量分數,將100g稀鹽酸分2次加入到盛有5g該樣品的燒杯中,所得數據如表,則下列說法中錯誤的是( )
次數 實驗前 第1次 第2次 加入稀鹽酸的質量/g 0 50 50 剩余固體的質量/g 5 3 2 A.第1次加入稀鹽酸后剩余固體中還有鎂 B.第2次所加入的稀鹽酸未反應完 C.每50g稀鹽酸和1g鎂恰好完全反應 D.合金樣品中銅的質量分數為40% 組卷:987引用:64難度:0.9 -
7.將質量相等、溶質質量分數相同的兩份稀硫酸分裝在甲、乙兩個燒杯中,再稱取質量相等的鋁和鋅,把鋁放入甲燒杯中,鋅放入乙燒杯中,待反應結束后,發現甲燒杯中鋁有剩余,乙燒杯中的鋅已全部反應,根據此現象推斷,下列結論中,正確的是( )
A.一定是乙燒杯中產生的氫氣多 B.可能是乙燒杯中產生的氫氣多 C.一定是甲燒杯中產生的氫氣多 D.可能甲、乙兩燒杯中產生的氫氣一樣多 組卷:160引用:7難度:0.7 -
 8.現有等質量甲、乙、丙三種金屬,分別放入三份溶質質量分數相同的足量稀硫酸中,產生氫氣的質量與反應時間的關系如圖所示(已知甲、乙、丙在生成物中化合價均為+2價)。則下列說法中不正確的是( )
8.現有等質量甲、乙、丙三種金屬,分別放入三份溶質質量分數相同的足量稀硫酸中,產生氫氣的質量與反應時間的關系如圖所示(已知甲、乙、丙在生成物中化合價均為+2價)。則下列說法中不正確的是( )A.生成氫氣的質量:甲>乙>丙 B.相對原子質量:乙>丙>甲 C.金屬活動性:乙>甲>丙 D.消耗硫酸的質量:甲>乙>丙 組卷:2890引用:211難度:0.7
八、解答題(共3小題,滿分0分)
-
25.A、B、C、D為金屬活動順序表中常見的四種金屬.已知:①A+BSO4=ASO4+B ②C+H2SO4=CSO4+H2↑ ③B+2DNO3=B(NO3)2+2D 請完成以下填空:
(1)金屬C在金屬活動順序表中排在氫(填“前面”或“后面”).
(2)根據上述反應能判斷出其中三種金屬的活動性,其金屬活動性由強到弱的順序是(用字母填寫).
(3)若A、B、C、D分別為鋅、鐵、銅、銀中的一種,金屬C與H2SO4反應后所得溶液呈淺綠色,則金屬A為,反應③的化學方程式為.組卷:929引用:74難度:0.7 -
26.某化學興趣小組的同學,為了比較金屬R與鐵、銅的金屬活動性強弱,進行如下探究活動:
【查閱資料】鐵的活動性比銅強.
【進行猜想】對三種金屬的活動性順序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:; 猜想三:Fe>Cu>R
【收集證據】為了驗證哪一種猜想成立,甲、乙、丙三位同學分別展開實驗探究.
寫出鐵絲在氧氣中燃燒的化學方程式主要操作 主要現象 實驗結論 甲 將打磨好的R絲插入盛有硫酸銅溶液的試管中 猜想一正確 乙 將粗細相同打磨好的R絲、鐵絲,分別插入體積和溶質質量分數都相同的稀鹽酸中 R絲表面產生氣泡速率比鐵絲表面產生氣泡速率 (填“快”或“慢”)丙 將粗細相同打磨好的R絲、鐵絲,分別在空氣中點燃 R絲在空氣中劇烈燃燒,鐵絲在空氣中不燃燒 .
【交流反思】三位同學交流討論后認為,比較金屬活動性強弱的方法有多種.
【歸納總結】他們總結得出比較金屬活動性強弱的常見方法有:
(1)金屬與氧氣反應的難易和劇烈程度;
(2)金屬與酸溶液是否反應或反應的劇烈程度;
(3)金屬與是否反應.組卷:1046引用:27難度:0.1


