2022年江蘇省南通市啟東中學高考化學最后一卷
發布:2024/10/31 10:30:3
一、單項選擇題:共14題,每題3分,共42分。每題只有一個選項最符合題意。
-
1.按照綠色化學的思想,最理想的“原子經濟性反應”就是反應物的原子全部轉化為期望的最終產物。下列工業生產涉及的反應中最符合“原子經濟性反應”的是( )
A.鈉與氧氣反應制取過氧化鈉 B.氯氣與石灰乳反應制取次氯酸鈣 C.一氧化碳還原氧化鐵冶煉鐵 D.二氧化硅與焦炭反應制取粗硅 組卷:71引用:5難度:0.6 -
2.工業上利用MgCl2?6H2O+6SOCl2
MgCl2+6SO2↑+12HCl↑制備無水MgCl2。下列說法正確的是( )△A.SO2為非極性分子 B.MgCl2中既含離子鍵又含共價鍵 C.H2O的電子式為 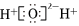
D.基態氧原子的價電子排布式為2s22p4 組卷:48引用:4難度:0.6 -
3.下列有關物質性質與用途具有對應關系的是( )
A.MgO熔點很高,可用作耐高溫材料 B.Al(OH)3受熱易分解,可用于制胃酸中和劑 C.FeCl3溶液顯酸性,可用于蝕刻印刷電路 D.NaClO溶液能與CO2反應,可用作漂白劑 組卷:55引用:5難度:0.8 -
4.閱讀下列資料,完成3~5題。
工業合成氨的反應為N2(g)+3H2(g)═2NH3(g)ΔH=-92.4kJ?mol-1.NH3可與酸反應制得銨鹽,可通過催化氧化生產HNO3,強堿條件下能被NaClO氧化生成N2H4;N2H4可被NaClO繼續氧化生成N2,也可被HNO2氧化生成HN3,N2H4能與AgNO3溶液反應產生銀鏡;HN3是一種弱酸,酸性與醋酸相當。
下列有關含氮化合物的性質與制備說法正確的是( )A.分析結構可推得,N2H4難溶于水 B.分析結構可推得,相同條件下NH3還原性應強于NH4+ C.制備N2H4時應將NH3慢慢通入NaClO溶液中 D.可向NaN3溶液中通CO2來制備HN3 組卷:20引用:0難度:0.50 -
5.閱讀下列材料,完成6~8題:如NOx是大氣中主要的污染物。大氣中過量的NOx和水體中過量的NH4+、NO2-、NO3-均是污染物。通過催化還原的方法,可將煙氣和機動車尾氣中的NO轉化為N2[反應為2NO(g)+2CO(g)?2CO2(g)+N2(g)ΔH=-746.5kJ?mol-1];也可將水體中的NO2-、NO3-轉化為N2。
對于反應2NO(g)+2CO(g)?2CO2(g)+N2(g),下列說法正確的是( )A.該反應在任何條件下都能自發進行 B.反應的平衡常數可表示為K= c(CO2)?c(N2)c(NO)?c(CO)C.使用高效的催化劑可以降低反應的焓變 D.其它條件不變,增大 的值,NO的轉化率下降c(NO)c(CO)組卷:30引用:0難度:0.70
二、非選擇題:共4題,共58分
-
17.以廢舊鋰離子電池的正極材料[活性物質為LixCoO2(x≤1)、附著物為炭黑、聚乙烯醇粘合劑、淀粉等]為原料,制備納米鈷粉和Co3O4。
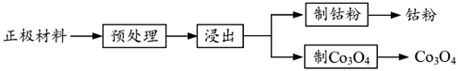
(1)預處理。將正極材料研磨成粉末后進行高溫煅燒。高溫煅燒的目的是。
(2)浸出。將煅燒后的粉末(含LixCoO2和少量難溶雜質)與硫酸混合,得到懸濁液,加入圖-1所示的燒瓶中。控制溫度為75°C,邊攪拌邊通過分液漏斗滴加雙氧水,充分反應后,濾去少量固體殘渣,得到Li2SO4、CoSO4和硫酸的混合溶液。浸出實驗中當觀察到,可以判斷反應結束,不再滴加雙氧水。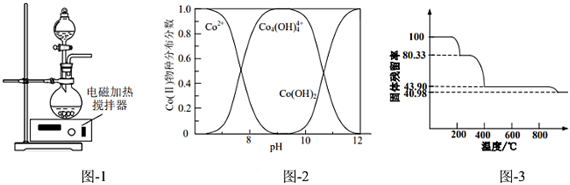
(3)制鈷粉。向浸出后的溶液中加入NaOH調節pH,接著加入N2H4?H2O可以制取單質鈷粉,同時有N2生成。已知不同pH時Co(Ⅱ)的物種分布圖如圖-2所示。Co2+可以和檸檬酸根離子(C6H5)生成配合物[CoC6H5O7]-。O3-7
①寫出pH=9時制鈷粉的離子方程式:。
②pH>10后所制鈷粉中由于含有Co(OH)2而導致純度降低。若向pH>10的溶液中加入檸檬酸鈉(Na3C6H5O7),可以提高鈷粉的純度,原因是。
(4)請補充完整由浸取后濾液先制備CoC2O4?2H2O,并進一步制取Co3O4的實驗方案:取浸取后濾液,,得到Co3O4。[已知:Li2C2O4易溶于水,CoC2O4難溶于水,CoC2O4?2H2O在空氣中加熱時的固體殘留率(×100%)與隨溫度的變化如圖-3所示。實驗中需使用的試劑有:2mol?L-1(NH4)2C2O4溶液、0.1mol?L-1BaCl2溶液]剩余固體質量原固體質量
(5)用下列實驗可以測定LixCoO2的組成:
實驗1:準確稱取一定質量的LixCoO2樣品,加入鹽酸,加熱至固體完全溶解(溶液中的金屬離子只存在Li+和Co2+),冷卻后轉移到容量瓶中并定容至100mL。
實驗2:移取25.00mL實驗1容量瓶中溶液,加入指示劑,用0.01000mol?L-1 EDTA(Na2H2Y)溶液滴定至終點(滴定反應為Co2++Y4-=CoY2-),平行滴定3次,平均消耗EDTA溶液25.00mL。
實驗3:準確稱取與實驗1中等質量的LixCoO2樣品,加入一定量的硝酸和H2O2溶液,加熱至固體完全溶解。冷卻后轉移到容量瓶中并定容至100mL。移取10.00mL溶液,通過火焰原子吸收光譜法測定其中Li+濃度為6.000×10-3mol?L-1。
計算LixCoO2樣品的化學式,并寫出計算過程。組卷:27引用:1難度:0.5 -
18.油煉、石化等工業會產生含硫(-2價)廢水,處理的方法有沉淀法、氧化法。
(1)沉淀法。用如圖1裝置可以將廢水中的硫轉化為FeS沉淀。控制其他條件一定,測得出口處硫轉化為FeS的沉淀率與溶液pH的關系如圖2所示。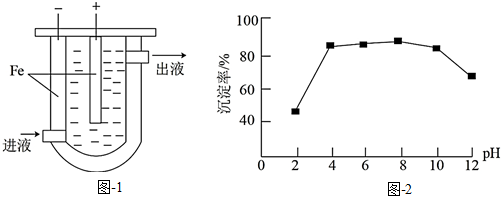
①該裝置沉淀廢水中的硫的原理可描述為。
②pH>10時,pH越大,硫轉化為FeS的沉淀率越低,可能的原因是。
(2)氧化法。Na2SO3氧化法、H2O2氧化法、催化氧化法等可以將含硫廢水中硫元素氧化。
①Na2SO3氧化法:向含S2-的廢水中,加入一定量的Na2SO3溶液,控制溶液的pH為5,可以生成S沉淀。寫出該反應的離子方程式:。
②H2O2氧化法:向含S2-的廢水中,加入H2O2溶液,其他條件一定,測得硫(-2價)的去除率、S(單質)的生成率與所加H2O2溶液體積的關系如圖3所示。當所加H2O2溶液體積大于9mL時,所加H2O2溶液越多,S生成率越低,原因是。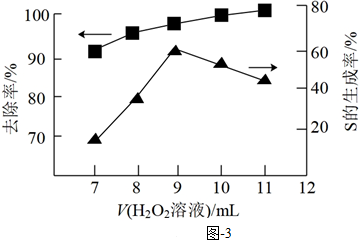
③催化氧化法:MnO2-苯胺(MnO2為催化劑、聚苯胺為催化劑載體)可用作空氣氧化含硫(-2價)廢水的催化劑。堿性條件下,催化氧化廢水的機理如圖4所示。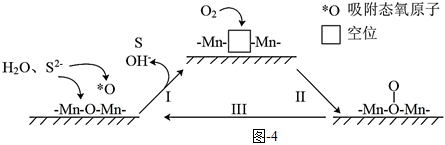
a.轉化Ⅰ中化合價發生變化的元素有。
b.催化劑使用一段時間后催化效率會下降,處理的方法是用氯仿(CHCl3)浸取催化劑,再將催化劑干燥即可,催化劑使用一段時間后催化效率降低的原因是。組卷:47引用:2難度:0.6


