2023-2024學年云南省昆明市官渡二中高三(上)期初化學試卷
發布:2024/8/17 0:0:1
一、選擇題;本題共22小題,每小題2分,共44分.在每小題給出的四個選項中,只有一項是符合題目要求的.
-
1.下列關于膠體的說法中不正確的是( )
A.可以通過過濾的方法將淀粉膠體中混有的氯化鈉溶液除去 B.分散質粒子的直徑:Fe(OH)3懸濁液>Fe(OH)3膠體>FeCl3溶液 C.一束平行光線射入蛋白質溶液里,從側面可以看到一條光亮的通路 D.制備Fe(OH)3膠體的方法是將飽和FeCl3溶液滴加到沸水中煮沸至溶液呈紅褐色 組卷:268引用:6難度:0.9 -
2.下列有關化學用語表示正確的是( )
A.原子核中有20個中子的氯原子: 3717ClB.CO2的結構式:O-C-O C.乙烯的結構簡式:CH2CH2 D.甲烷分子的球棍模型: 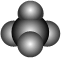 組卷:3引用:1難度:0.9
組卷:3引用:1難度:0.9 -
3.下列對同系物歸納錯誤的是( )
A.同系物都符合同一通式 B.同系物彼此在組成上相差一個或若干個某種原子團 C.同系物具有相同的最簡式 D.同系物的結構相似 組卷:230引用:3難度:0.7 -
4.下列關于原子核外電子排布與元素在周期表中位置關系的表述中,正確的是( )
A.最外層有三個未成對電子的原子一定為主族元素原子 B.基態原子的價電子排布為(n-1)dxnsy的元素的族序數一定為x+y C.在元素周期表中,所有非金屬元素都位于p區 D.在一個基態多電子的原子中,M層上的電子能量不一定比L層上的電子能量高 組卷:13引用:3難度:0.7 -
5.在恒溫恒容密閉容器中充入2molCO2、2molH2合成乙醇:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)。下列敘述錯誤的是( )
A.任意時刻,H2的轉化率大于CO2 B.CO2的體積分數不變化時反應一定達到平衡狀態 C.體系中水蒸氣的體積分數是乙醇的3倍 D.反應達到最大限度時體系中存在4種物質 組卷:18引用:1難度:0.7 -
6.下列說法不正確的是( )
A.35Cl2和37Cl2互為同位素 B.金剛石、石墨、C60互為同素異形體 C.CH3OCH3和CH3CH2OH互為同分異構體 D.CH4和C2H6互為同系物 組卷:14引用:1難度:0.8 -
7.用以下三種途徑來制取等質量的硝酸銅.
①銅與稀硝酸反應;②銅與濃硝酸反應;③銅先與氧氣反應生成氧化銅,氧化銅再跟硝酸反應.
以下敘述不正確的是( )A.三種途徑所消耗的銅的質量相等 B.所消耗的硝酸的物質的量是①>②>③ C.途徑③的制備方法是最符合“綠色化學”理念的 D.途徑①中被氧化的銅與被還原的硝酸的物質的量比是3:2 組卷:187引用:7難度:0.7 -
8.某同學認為下列四組離子均不能大量共存于同一溶液中,該同學的判斷及理由正確的是( )
離子種類 理由 A Ca2+、OH-、 、Cl-HCO-3有CaCO3沉淀生成 B K+、OH-、I-、 NO-3可將I-氧化NO-3C Al3+、Fe3+、SCN-、Cl- Fe3+和SCN-可形成沉淀 D Ca2+、Na+、ClO-、 NO-3Ca2+和ClO-可形成沉淀 A.A B.B C.C D.D 組卷:23引用:2難度:0.7 -
9.下列離子方程式正確的是( )
A.將氯氣通入石灰乳中Cl2+2OH-═Cl-+ClO-+H2O B.碳酸鈣溶于醋酸CaCO3+2H+═Ca2++CO2↑+H2O C.鈉與水反應:Na+2H2O═Na++2OH-+H2↑ D.向Fel2溶液中通入過量的Cl2:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl- 組卷:22引用:3難度:0.7
二、填空題:56分
-
26.我國科學家利用Fe2Na3/紅紫素催化劑實現CO2還原制備CO,利用可見光催化還原CO2,將CO2轉化為增值化學原料(HCOOH、HCHO、CH3OH等),這被認為是一種可持續的CO2資源化有效途徑。
(1)已知幾種物質的燃燒熱(ΔH)如表1所示:
已知:H2O(g)=H2O(l)ΔH=-44kJ?mol-1。CO2(g)+2H2(g)?HCHO(g)+H2O(g)ΔH=物質 HCHO(g) H2(g) 燃燒熱(ΔH)/(kJ?mol-1) -570.8 -285.8 kJ?mol-1
(2)在一定溫度下,將1molCO2(g)和3molH2(g)通入某恒容密閉容器中,發生反應CO2(g)+H2(g)?HOOH(g),測得不同時刻容器中CO2的體積分數[φ(CO2)]如表2所示。
達到平衡時CO2的轉化率為t/min 0 10 20 30 40 50 φ(CO2) 0.250 0.230 0.215 0.205 0.200 0.200 。
(3)將n(CO2):n(H2)=1:4的混合氣體充入某密閉容器中,同時發生反應1和反應2。
反應1:CO2(g)+H2(g)?CO(g)+H2O(g).ΔH1=+41.2kJ?mol-1
反應2:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH2<0。
在不同溫度、壓強下,測得相同時間內CO2的轉化率如圖1。0.1MPa時,CO2的轉化率在600℃之后隨溫度升高而增大的主要原因是。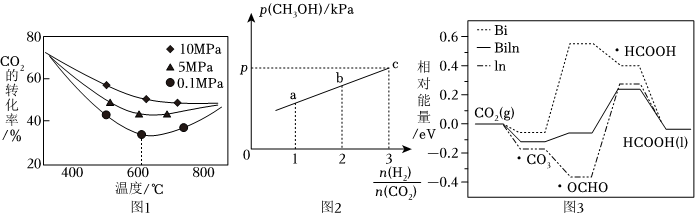
(4)在一定溫度下,向容積為2L的恒容密閉容器中充入1molCO2(g)和nmolH2(g),僅發生(3)中的反應2。實驗測得CH3OH的平衡分壓與起始投料比[]的關系如圖2。n(H2)n(CO2)
①起始時容器內氣體的總壓強為8pkPa,若10min時反應到達c點,則0~10min內,v(H2)=mol?L-1?min-1
②b點時反應的平衡常數Kp=(用含p的表達式表示)(kPa)-2。(已知:用氣體分壓計算的平衡常數為Kp,分壓=總壓×物質的量分數)
(5)我國科學家開發催化劑,以惰性材料為陽極,在酸性條件下電解還原CO2制備HCHO,其陰極的電極反應式為。
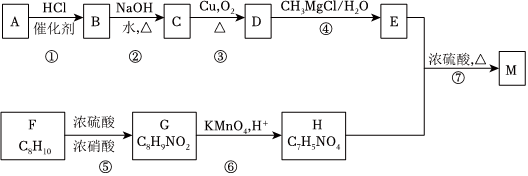
(6)我國學者探究了BiIn合金催化劑電化學還原CO2生產HCOOH的催化性能及機理,并通過DFT計算催化劑表面該還原過程的物質的相對能量,如圖3所示(帶“*”表示物質處于吸附態)。試從圖3分析,采用BiIn合金催化劑優于單金屬Bi催化劑的原因:;BiIn合金催化劑優于單金屬In催化劑的原因:。組卷:33引用:3難度:0.7 -
27.酯類物質M是一種藥物的主要合成中間體,其合成路線如圖:
已知以下信息:
①芳香烴A的相對分子質量在100-110之間,1molA完全燃燒可消耗10molO2.
②H的核磁共振氫譜顯示其有3種氫.
③RCH=CH2RCHClCH3HCl催化劑
④RX+MgRMgX(X代表鹵素)乙醚
⑤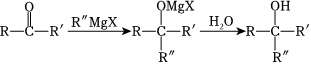
回答下列問題:
(1)A的結構簡式為,H中官能團的名稱為.
(2)由E和H生成M的化學方程式為.
(3)屬于氧化反應的是(填序號).
(4)同時符合下列條件的E的同分異構體有種(不考慮立體異構),其中苯環上一氯代物只有兩種的結構簡式為.(任寫一種)
①能與碳酸鈉溶液發生反應;②苯環上的取代基數目有2個,
(5)請結合所給信息,由苯合成苯乙烯,合成路線如圖所示,請回答下列問題.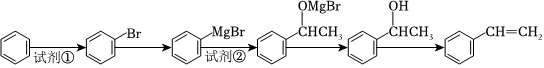
試劑②為,最后一步反應的化學方程式為.組卷:9引用:2難度:0.5


