2022-2023學年黑龍江省大慶鐵人中學高二(上)第一次月考化學試卷
發布:2024/12/19 9:30:7
一、選擇題(每小題只有一個選項正確,共20小題,1-10題,每小題3分,11-20題,每小題3分,共50分。)
-
1.下列不屬于自發進行的變化是( )
A.紅墨水加到清水使整杯水變紅 B.冰在室溫下融化成水 C.電解飽和食鹽水 D.鐵器在潮濕的空氣中生銹 組卷:64引用:8難度:0.9 -
2.下列說法正確的是( )
A.活化分子的每一次碰撞都能發生化學反應 B.催化劑能提高反應的活化能,從而加快反應速率 C.反應物用量增加后,會使有效碰撞次數增多,反應速率增大 D.能發生有效碰撞的分子一定是活化分子 組卷:7引用:1難度:0.7 -
3.對于合成氨反應,N2(g)+3H2(g)?2NH3(g)△H<0.達到平衡后,以下分析正確的是( )
A.升高溫度,對正反應的反應速率影響更大 B.增大壓強,對正反應的反應速率影響更大 C.減小反應物濃度,對逆反應的反應速率影響更大 D.加入催化劑,對逆反應的反應速率影響更大 組卷:184引用:14難度:0.7 -
4.在密閉容器中進行如下反應:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始濃度分別為0.1mol?L-1、0.3mol?L-1、0.2mol?L-1,在一定條件下,當反應達到平衡時,各物質的濃度有可能是( )
A.X2為0.2mol?L-1 B.Y2為0.2mol?L-1 C.Z為0.3mol?L-1 D.Z為0.45mol?L-1 組卷:30引用:4難度:0.7 -
5.煤液化制乙醇的反應如下:2CO(g)+4H2(g)?CH3CH2OH(l)+H2O(l) ΔH<0,若利用這個反應進行乙醇(CH3CH2OH)的工業化生產,采取的措施正確的是( )
A.適宜溫度、高壓、催化劑 B.低溫、高壓、催化劑 C.低溫、低壓 D.高溫、高壓 組卷:26引用:5難度:0.5 -
6.某可逆反應aA+bB?cC在某溫度下的平衡常數為K(K≠1),反應熱為ΔH。保持溫度不變,將方程式的書寫作如下改變,則ΔH和K數值的相應變化為( )
A.寫成2aA+2bB?2cC,ΔH值、K值均擴大了一倍 B.寫成2aA+2bB?2cC,ΔH值變為原來的平方,K值擴大了一倍 C.寫成cC?aA+bB,ΔH值、K值變為原來的相反數 D.寫成cC?aA+bB,ΔH值變為原來的相反數,K值變為原來的倒數 組卷:48引用:3難度:0.5 -
7.下列事實不能用勒夏特列原理解釋的是( )
A.用排飽和食鹽水的方法收集Cl2 B.在一定條件下,氫氣和碘蒸氣反應達到平衡后,加壓,混合氣體顏色加深 C.反應CO(g)+NO2(g)=CO2(g)+NO(g)(正反應為放熱反應),達平衡后,升高溫度體系顏色變深 D.合成三氧化硫過程中使用過量的氧氣,以提高二氧化硫的轉化率 組卷:3引用:1難度:0.6 -
8.對于可逆反應A(g)+2B(g)?2C(g),△H>0,下列圖象中正確的是( )
A. 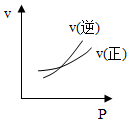
B. 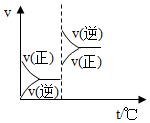
C. 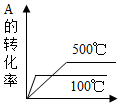
D. 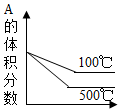 組卷:169引用:10難度:0.9
組卷:169引用:10難度:0.9
二、非選擇題(共4小題,共50分)
-
23.Ⅰ.為確定MnO2催化雙氧水分解的最佳條件,用該實驗裝置進行實驗,反應物用量和反應停止的時間數據如表。
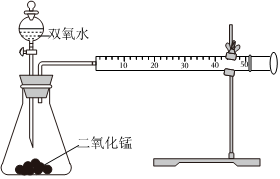
分析表中數據回答下列問題:MnO2時間
H2O20.1g 0.3g 0.8g 10mL1.5% 223s 67s 56s 10mL3.0% 308s 109s 98s 10mL4.5% 395s 149s 116s
(1)相同濃度的過氧化氫的分解速率隨著MnO2用量的增加而(填“加快”、“減慢”或“不變”)。
(2)從實驗效果和“綠色化學”的角度考慮,雙氧水的濃度相同時,加入g的MnO2為較佳選擇。
(3)該小組的某同學分析上述數據后得出:“當用相同質量的MnO2時,雙氧水的濃度越小,所需要的時間就越少,亦即其反應速率越快”的結論,你認為是否正確?(填“正確”或“不正確”),理由是(提示:H2O2溶液的密度可認為近似相等)。
Ⅱ.某化學實驗小組發現鎂和NaHCO3溶液反應比鎂和水反應速率快,通過實驗探究速率加快原因和產物成分。
(1)速率加快的原因探究
小組同學為研究速率加快可能的原因,分別取0.1g打磨的鎂條進行了如下實驗
已知:Mg和H2O反應只能在Mg表面產生微量氣泡,實驗組1 6mL1mol/LNaHCO3溶液(pH=8.4) 持續產生大量氣泡,溶液略顯渾濁 實驗組2 6mL1mol/LNaNO3溶液 鎂表面微量氣泡附著 在中性或堿性條件下不與鎂反應。設計實驗組2的目的是NO-3,為控制變量與實驗組1一致,應對實驗組2進行改進,具體操作為。
(2)產物成分探究
①將產生的氣體點燃有藍色火焰,通入澄清的石灰水變渾濁,則推測氣體成分為H2和CO2。
②某同學認為逸出的氣體會帶出少量溶液也能使澄清石灰水變渾濁。于是在密閉容器中利用CO2傳感器測定15分鐘三組不同情況下CO2氣體濃度變化。實驗組3 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,但不加入鎂條 實驗組4 6mL1mol/LNaHCO3溶液加入250mL塑料瓶,并加入0.1g打磨的鎂條 實驗組5 空塑料瓶 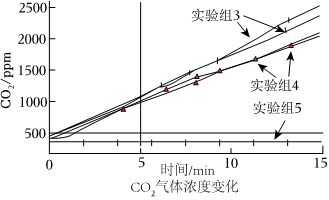
測量時取少量NaHCO3溶液,少量鎂條的原因是;通過圖象可以確定鎂和NaHCO3溶液反應生成的氣體為。組卷:6引用:1難度:0.6 -
24.二甲醚(CH3OCH3)是優良的潔凈燃料,利用CO2催化加氫制二甲醚過程中發生的化學反應為
反應Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)ΔH1>0
反應Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)ΔH2<0
反應Ⅲ:2CH3OH(g)?CH3OCH3(g)+H2O(g)ΔH3<0
一定條件下,在恒容密閉容器中按=3投料進行上述反應,CO2的平衡轉化率及CO、CH3OCH3、CH3OH的平衡體積分數隨溫度變化如圖所示。n(H2)n(CO2)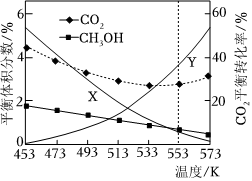
(1)圖中曲線X表示的平衡體積分數隨溫度變化,溫度從453K上升至573K,CO2的平衡轉化率變化的原因是,能同時提高CH3OCH3的平衡體積分數和CO2的平衡轉化率的措施是。
(2)一定溫度下,向體積為1L的恒容密閉容器中通入1molCO2和3molH2進行上述反應,反應經10min達平衡,CO2的平衡轉化率為30%,容器中CO(g)為0.05mol,CH3OH(g)為0.05mol。前10minCH3OCH3(g)的反應速率為。繼續向容器中加入0.1molCH3OH(g)和0.1molH2O(g),此時反應Ⅲ(填“向正反應方向進行”“向逆反應方向進行”或“處于平衡狀態”)。
(3)氮氧化物發生的反應是討論化學平衡問題的常用體系。對于反應2NO+O2?2NO2,有人提出如下反應歷程:
第一步2NO?N2O2 快速平衡
第二步N2O2+O2→2NO2 慢反應
其中可近似認為第二步反應不影響第一步的平衡。下列表述正確的是(填字母)。
A.v(第一步的逆反應)<v(第二步反應)
B.N2O2是反應的中間產物
C.第二步反應活化能較高
D.第二步中N2O2與O2的每一次碰撞均是有效碰撞
(4)已知:N2O4(g)?2NO2(g)ΔH>0。298K時,將一定量N2O4氣體充入恒容的密閉容器中發生反應。t1時刻反應達到平衡,混合氣體平衡總壓強為p,N2O4氣體的平衡轉化率為25%,則反應N2O4(g)?2NO2(g)的平衡常數Kp=(分壓=總壓×物質的量分數),研究發現,v正=k正?p(N2O4),v逆=k逆?p2(NO2)。若上述反應在298K,總壓強p=1.5kPa,k逆=60s-1,則k正=(注明速率常數單位)。組卷:19引用:1難度:0.7


