2023-2024學年北京理工大學附中高二(上)期中化學試卷
發布:2024/10/17 17:0:4
一、單選題(每小題2分,共48分)
-
1.廢電池造成污染的問題日益受到關注.集中處理廢電池的首要目的是( )
A.回收石墨電極 B.利用電池外殼的金屬材料 C.防止電池中滲泄的電解液腐蝕其他物品 D.防止電池中汞、鎘和鉛等重金屬離子對土壤和水源的污染 組卷:377引用:20難度:0.9 -
2.下列事實不能用勒夏特列原理解釋的是( )
A.紅棕色NO2加壓后顏色先變深后變淺 B.實驗室中常用排飽和食鹽水的方法收集氯氣 C.SO2催化氧化成SO3的反應,使用過量的空氣以提高二氧化硫的利用率 D.壓縮H2與I2(g)反應的平衡混合氣體,顏色變深 組卷:54引用:9難度:0.9 -
3.反應C(s)+H2O(g)?CO(g)+H2(g)在一體積可變的密閉容器中進行,你和化學老師嘗試改變下列條件,對其反應速率幾乎無影響的是( )
①增加C的量
②將容器體積縮小一倍
③保持體積不變,充入N2使體系壓強增大
④保持壓強不變,充入N2使體系體積增大A.①③ B.①④ C.②③ D.③④ 組卷:84引用:2難度:0.7 -
4.在恒容密閉容器中反應2NO2(g)?N2O4(g)該反應達平衡的標志是( )
①混合氣顏色不隨時間的變化
②數值上v(NO2生成)=2v(N2O4消耗)
③混合氣體的密度不隨時間的變化
④壓強不隨時間的變化而變化
⑤混合氣的平均分子量不變A.②⑤④ B.①④⑤ C.①③④ D.①②③ 組卷:42引用:1難度:0.8 -
5.生產鈦的方法之一是將金紅石(TiO2)轉化為TiCl4,再進一步還原得到鈦。TiO2轉化為TiCl4有直接氯化法和碳氯化法,相關能量示意圖如圖所示。下列說法不正確的是( )
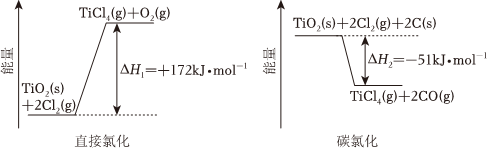
A.將反應物固體粉碎可以加快直接氯化,碳氯化的反應速率 B.可推知2C(s)+O2(g)═2CO(g)ΔH=-111.5kJ?mol-1 C.判斷直接氯化反應能否自發進行需要綜合考慮體系的焓變和熵變 D.對于碳氯化反應,溫度升高,平衡時TiCl4(g)的產率變小 組卷:42引用:2難度:0.7 -
6.N2O與CO在Fe+作用下發生反應的能量變化及反應歷程如圖所示。下列說法中,不正確的是( )

A.該反應的ΔH<0 B.Fe+使反應的活化能減小 C.催化劑通過參與反應改變了反應歷程 D.上述過程在Fe+作用下,提高了N2O與CO的平衡轉化率 組卷:62引用:6難度:0.6 -
7.H2和I2在一定條件下能發生反應:H2(g)+I2(g)?2HI(g)ΔH=-a kJ?mol-1
已知 (a、b、c均大于零)
(a、b、c均大于零)
下列說法不正確的是( )A.反應物的總能量高于生成物的總能量 B.斷開1mol H-H鍵和1mol I-I鍵所需能量大于斷開2mol H-I鍵所需能量 C.斷開2mol H-I鍵所需能量約為(c+b+a)kJ D.向密閉容器中加入2mol H2和2mol I2,充分反應后放出的熱量小于2a kJ 組卷:36引用:10難度:0.7 -
8.下列示意圖與化學用語表述閃容不相符的是(水合離子用相應離子符號表示)( )
A B C D
NaCl溶于水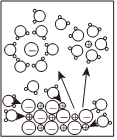
銅鋅原電池工作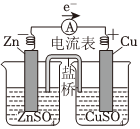
一種燃料電池工作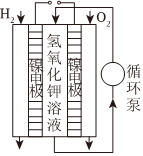
電解飽和食鹽水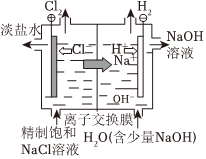
電離方程式:NaCl═Na++Cl- 總反應:Zn+Cu2+═Zn2++Cu 負極反應:H2-2e-+2OH-═2H2O 總反應:2Cl-+2H+ Cl2↑+H2↑通電A.A B.B C.C D.D 組卷:63引用:3難度:0.7 -
9.化學小組研究金屬的電化學腐蝕,實驗如下:
下列說法不正確的是( )序號 實驗Ⅰ 實驗Ⅱ 實驗 

現象 鐵釘周邊出現藍色銅片周邊略顯紅色 鐵釘周邊出現_______色
鋅片周邊未見明顯變化A.實驗Ⅰ中正極的電極反應式:O2+2H2O+4e-=4OH- B.實驗Ⅱ中鐵釘周邊出現紅色 C.實驗Ⅱ中負極的電極反應式:Fe-2e-=Fe2+ D.對比實驗Ⅰ、Ⅱ可知,生活中鍍鋅鐵板比鍍銅鐵板在鍍層破損后更耐腐蝕 組卷:30引用:1難度:0.6
二、填空題(52分)
-
27.用甲烷制高純氫氣是目前研究熱點之一.
(1)一定條件下,CH4(g)?C(s)+2H2(g)反應歷程如圖1所示,其中化學反應速率最慢的反應過程為.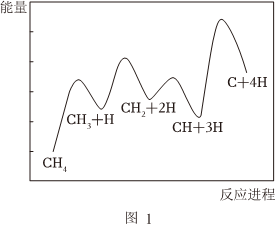
(2)甲烷水蒸氣催化重整可制得較高純度的氫氣,相關反應如下.
反應Ⅰ.CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+206kJ?mol-1
反應Ⅱ.CO(g)+H2O(g)?CO2(g)+H2(g)ΔH2=-41kJ?mol-1
①總反應:CH4(g)+2H2O(g)?CO2(g)+4H2(g)ΔH=.
②已知830℃時,反應Ⅱ的平衡常數K=1.在容積不變的密閉容器中,將2molCO與8molH2O加熱到830℃,反應達平衡時CO的轉化率為.
③在常壓,600℃條件下,甲烷制備氫氣的總反應中H2平衡產率為82%.若加入適量生石灰后H2的產率可提高到95%,應用化學平衡移動原理解釋原因.
(3)科學家研究將CH4、H2O與CH4、CO2聯合重整制備氫氣:
反應Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)ΔH1=+206kJ?mol-1
反應Ⅲ:CH4(g)+CO2(g)?2CO(g)+2H2(g)ΔH3=+247kJ?mol-1
常壓下,將CH4、H2O和CO2按一定比例混合置于密閉容器中,相同時間不同溫度下測得體系中n(H2):n(CO)變化如圖2所示.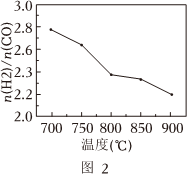
①已知700℃、NiO催化劑條件下,向反應體系中加入少量O2可增加H2產率,此條件下還原性COH2(填“>”“<”或“=”).
②隨著溫度升高n(H2):n(CO)變小的原因可能是.組卷:41引用:4難度:0.6 -
28.某小組研究Cu2+和Fe3+的氧化性,進行如下實驗。
實驗Ⅰ:
已知:(SCN)2是黃色液體,氧化性:l2<(SCN)2<Br1。
(1)實驗Ⅰ過程中Cu與FeCl3反應的化學方程式是。
(2)實驗Ⅰ過程Ⅱ中溶液變紅,說明產生了Fe3+,分析可能原因。
假設①Fe2+被Cu2+氧化。過程Ⅱ發生反應的電極反應式:
a.氧化反應:Fe2+-e-+3SCN-=Fe(SCN)3
b.還原反應:。
假設②Cu2+和SCN-生成(SCN)2,進而使清液中的Fe2+氧化,設計實驗Ⅱ證實假設。
實驗Ⅱ:
i.x=。
ⅱ.實驗Ⅱ中過程Ⅱ的離子方程式為。
(3)設計實驗進一步研究Fe3+能否氧化SCN-
①實驗Ⅲ中K3[Fe(CN)6]溶液的作用是編號 實驗Ⅲ 實驗Ⅳ 實驗及現象 
 。
。
②實驗Ⅳ證實Fe3+能氧化SCN-的實驗現象除電流表指針偏轉外,還有(答出2點)。
③實驗Ⅲ中Fe3+未能氧化SCN-的原因:。組卷:11引用:1難度:0.5


