2011-2012學年遼寧省大連市瓦房店高級中學高二(下)暑假化學作業(七)
發布:2024/4/20 14:35:0
一、選擇題(包括20小題,1--10每小題2分,11-20每小題2分共50分.每小題只有一個選項符合題意)
-
1.強弱電解質的本質區別是( )
A.導電能力 B.化學鍵的類型 C.電離程度 D.溶解度 組卷:46引用:11難度:0.9 -
2.下列說法正確的是( )
A.需要加熱的化學反應都是吸熱反應 B.應用蓋斯定律可以計算某些難以測量的反應焓變 C.鹽類的水解反應是放熱反應 D.在吸熱反應中,反應物的總能量比產物的總能量高 組卷:11引用:4難度:0.9 -
3.下列過程或現象與鹽類水解無關的是( )
A.純堿溶液去油污 B.加熱稀醋酸溶液其pH稍有減小 C.實驗室配制FeCl3溶液時,加入少量稀鹽酸,以防止溶液渾濁 D.水中加入明礬可以凈化水 組卷:17引用:8難度:0.9 -
4.濃度為2mol?L-1的NaOH溶液150mL,吸收了4.48LCO2(標準狀況).下列說法正確的是( )
A.HCO3-離子數略多于CO32-離子數 B.HCO3-離子數等于CO32-離子數 C.HCO3-離子數略少于CO32-離子數 D.Na+離子數等于HCO3-離子數和CO32-離子數之和 組卷:14引用:2難度:0.7 -
5.下列屬于正確的水解離子方程式的是( )
A.NH4++H2O?NH3?H2O+H+ B.H2O+H2O?H3O++OH- C.CO32-+2H2O?H2CO3+2OH- D.Fe3++3H2O?Fe(OH)3↓+3H+ 組卷:33引用:5難度:0.9 -
6.廢電池造成污染的問題日益受到關注.集中處理廢電池的首要目的是( )
A.回收石墨電極 B.利用電池外殼的金屬材料 C.防止電池中滲泄的電解液腐蝕其他物品 D.防止電池中汞、鎘和鉛等重金屬離子對土壤和水源的污染 組卷:377引用:20難度:0.9 -
7.下列過程中需要通電才可以進行的是( )
①電離 ②電解 ③電鍍 ④電化學腐蝕.A.①②③ B.②③④ C.②③ D.全部 組卷:72引用:22難度:0.9 -
8.化學用語是學習化學的重要工具,下列化學用語中,正確的是( )
A.NH4+的水解反應離子方程式:NH4++H2O?NH3?H2O+H+ B.在AgCl懸濁液中加入KI溶液充分振蕩:Ag++I-=AgI↓ C.鍍銅時,陽極的電極反應式為:Cu2++2e-═Cu D.某反應△H<0,則該反應在任意條件下均可自發進行 組卷:14引用:11難度:0.7
二、非選擇題(本題包括4小題,共50分,)
-
 23.下列物質 ①Cu ②液態SO2 ③純醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
23.下列物質 ①Cu ②液態SO2 ③純醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
I、屬于非電解質的是;(填序號)
Ⅱ、(1)NaHCO3是一種(填“強”或“弱”)電解質;
(2)寫出HCO3-水解的離子方程式:;
(3)常溫下,0.1mol?L-1NaHCO3溶液的pH大于8,則溶液中Na+、HCO3-、H2CO3、CO32-、OH- 五種微粒的濃度由大到小的順序為:.
(4)常溫常壓下,空氣中的CO2溶于水,達到平衡時,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的電離及H2CO3的第二級電離,則H2CO3?HCO3-+H+的平衡常數K1=.(已知:10-5.60=2.5×10-6)
Ⅲ、Ba(OH)2是一種強電解質,現有25℃、pH=13的Ba(OH)2溶液.
(1)該Ba(OH)2溶液的物質的量濃度為;
(2)溶液中由水電離出c(OH-)=;
(3)與某濃度鹽酸溶液按體積比(堿與酸之比)1:9混合后,所得溶液pH=11(假設混合溶液的體積等于混合前兩溶液的體積和),該鹽酸溶液的pH=.
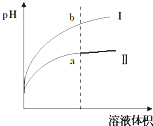
Ⅳ、醋酸是一種弱電解質.某溫度下,相同pH值的鹽酸和醋酸溶液分別加水稀釋,平衡pH值隨溶液體積變化的曲線如右圖所示.則圖(填“I”或“Ⅱ”)為醋酸稀釋的圖象.組卷:16引用:3難度:0.5 -
24.硫酸工業中SO2轉化為SO3是重要的反應之一,在一定壓強和催化劑作用下在2L密閉容器中充入0.8molSO2和2molO2發生反應:2SO2(g)+O2(g)
2SO3(g),SO2的轉化率隨溫度的變化如下表所示:催化劑加熱
(1)由表中數據判斷△H溫度℃ 450 500 550 600 SO2的轉化率% 97.5 95.8 90.50 80.0 0(填“>”、“=”或“<”)
(2)能判斷該反應是否達到平衡狀態的是
A.容器的壓強不變 B.混合氣體的密度不變
C.混合氣體中SO3的濃度不變 D.C(SO2)=C(SO3)
E.v正(SO2)=v正(SO3) F.v正(SO3)=2v逆(O2)
(3)某溫度下經2min反應達到平衡后C(SO2)=0.08mol?L-1.
①0~2min之間,O2的反應速率為.
②此時的溫度為℃.
③此溫度下的平衡常數為(可用分數表示).
(4)若將平衡反應混合物的壓強增大(假如體積可變),平衡將向移動.組卷:14引用:3難度:0.5


