魯科版(2019)選擇性必修1《3.3 沉淀溶解平衡》2020年同步練習卷(4)
發布:2024/10/27 12:30:2
-
1.在溫熱氣候條件下,淺海地區有厚層的石灰石沉積,而深海地區卻很少。下列解析不正確的是( )
A.與深海地區相比,淺海地區水溫較高,有利于游離的CO2增多、石灰石沉積 B.與淺海地區相比,深海地區壓強大,石灰石巖層易被CO2溶解,沉積少 C.深海地區石灰石巖層的溶解反應為:CaCO3(s)+H2O(l)+CO2(aq)═Ca(HCO3)2(aq) D.海水里弱酸性,大氣中CO2濃度增加,會導致海水中CO32-濃度增大 組卷:617引用:7難度:0.5 -
2.把氫氧化鈣放入蒸餾水中,一定時間后達到如下平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)。加入以下溶液,可使Ca(OH)2減少的是( )
A.Na2S B.AlCl3 C.C.NaOH D.CaCl2 組卷:123引用:4難度:0.8 -
3.對于難溶鹽MX,其飽和溶液中的M+和X-的物質的量濃度之間的關系近似于:c(H+)?c(OH-)=KW,存在著c(M+)?c(X-)=Ksp的關系.現將足量AgCl固體分別放入下列物質中,AgCl溶解度由大到小的排列順序為( )
①20mL 0.01mol?L-1KCl溶液
②30mL 0.02mol?L-1CaCl2溶液
③40mL 0.03mol?L-1HCl溶液
④10mL蒸餾水
⑤50mL 0.05mol?L-1AgNO3.A.①>②>③>④>⑤ B.④>①>③>②>⑤ C.⑤>④>②>①>③ D.④>③>⑤>②>① 組卷:119引用:17難度:0.7 -
4.CaSO4有很多用途,例如制豆腐就用到石膏(主要成分是CaSO4).CaSO4微溶于水,溶于水的部分可以形成CaSO4飽和溶液,其飽和溶液中存在平衡:CaSO4(s)?Ca2+(aq)+SO42-(aq),分別采取下列措施,能使溶液中c(Ca2+)增大的是( )
A.降溫 B.加入CaSO4 C.加入BaCl2 D.加水 組卷:64引用:4難度:0.9 -
5.下列說法正確的是( )
A.在一定溫度下的AgCl水溶液中,Ag+和Cl-濃度的乘積是一個常數 B.AgCl的Ksp=1.8×10-10,在任何含AgCl固體的溶液中,c(Ag+)=c(Cl-),且Ag+和Cl-濃度的乘積等于1.8×10-10 C.溫度一定時,在AgCl飽和溶液中,Ag+和Cl-濃度的乘積是一個常數 D.向飽和AgCl溶液中加入鹽酸,Ksp變大 組卷:42引用:6難度:0.7
-
16.NiSO4?xH2O是一種綠色易溶于水的晶體,廣泛用于鍍鎳、電池等,可由電鍍廢渣(除鎳外還含有銅、鋅、鐵等元素)為原料獲得。操作步驟如圖。
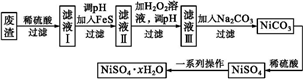
(1)電鍍在銅上的鎳層破損后,鍍層(填“能”或“否”)繼續保護內部金屬。
(2)向濾液Ⅰ中加入FeS的目的是,當Zn2+恰好沉淀完全時,則c平(Cu2+)=mol?L-1[已知Ksp(CuS)=1.3×10-36mol2?L-2,Ksp(ZnS)=1.6×10-24mol2?L-2]。
(3)對濾液Ⅱ中加入H2O2時發生的反應離子方程式為。
(4)濾液Ⅲ中溶質的主要成分是NiSO4,加入Na2CO3過濾后再加適量稀硫酸溶解又生成NiSO4,這兩步操作的目的是。
(5)為測定NiSO4?xH2O晶體中x的值,稱取5.26g晶體加熱至完全失去結晶水,剩余固體3.10 g,則x的值為。組卷:6引用:1難度:0.4 -
17.某硫酸工廠的酸性廢水中砷(As)元素含量極高,為控制砷的排放,采用化學沉降法處理含砷廢水,相關數據如下表.請回答以下問題:
表1.幾種鹽的Ksp
表2.工廠污染物排放濃度及允許排放標準難溶物 Ksp Ca3(AsO4)2 6.8×10-19 CaSO4 9.1×10-6 FeAsO4 5.7×10-21
(1)該硫酸工廠排放的廢水中硫酸的物質的量濃度c(H2SO4)=污染物 H2SO4 As 廢水濃度 29.4g/L 1.6g?L-1 排放標準 pH 6~9 0.5mg?L-1 mol?L-1.
(2)若酸性廢水中Fe3+的濃度為1.0×10-4mol?L-1,c()=AsO3-4mol?L-1.
(3)工廠排放出的酸性廢水中的三價砷(H3AsO3弱酸)不易沉降,可投入MnO2先將其氧化成五價砷(H3AsO4弱酸),MnO2被還原為Mn2+,反應的離子方程式為.
(4)在處理含砷廢水時采用分段式,先向廢水中投入生石灰調節pH到2,再投入生石灰將pH調節到8左右使五價砷以Ca3(AsO4)2形式沉降.
①將pH調節到2時廢水中有大量沉淀產生,沉淀主要成分的化學式為;
②Ca3(AsO4)2在pH調節到8左右才開始沉淀,原因為.
③砷酸(H3AsO4)分步電離的平衡常數(25℃)為:K1=5.6×10-3K2=1.7×10-7K3=4.0×10-12,
第三步電離的平衡常數的表達式為K3=.Na3AsO4的第一步水解的離子方程式為:+H2O?AsO3-4+OH-,該步水解的平衡常數(25℃)為:HAsO2-4(保留兩位有效數字).組卷:50引用:5難度:0.5


