2022-2023學年湖南省長沙市明德中學高二(上)期中化學試卷
發布:2024/9/3 0:0:8
一、選擇題:本題共12小題,每小題3分,共36分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.下列食品添加劑中,其使用目的與反應速率有關的是( )
A.抗氧化劑 B.調味劑 C.著色劑 D.增稠劑 組卷:1716引用:89難度:0.8 -
2.合理利用某些鹽能水解的性質,能解決許多生產、生活中的問題,下列敘述的事實與鹽水解的性質無關的是( )
A.長期施用銨態氮肥會使土壤酸化 B.配制FeSO4溶液時,加入一定量Fe粉 C.金屬焊接時可用NH4Cl溶液作除銹劑 D.將AlCl3溶液蒸干得不到原溶質 組卷:71引用:3難度:0.6 -
3.能夠增加反應物分子中活化分子百分數的措施是( )
A.升高溫度 B.減小壓強 C.增大壓強 D.增大濃度 組卷:50引用:10難度:0.9 -
4.合成氨所需的氫氣可用煤和水作原料經多步反應制得,其中的一步反應為:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反應達到平衡后,為提高CO的轉化率,下列措施中正確的是( )催化劑A.增加壓強 B.降低溫度 C.增大CO的濃度 D.更換催化劑 組卷:990引用:90難度:0.9 -
5.下列實驗事實不能說明醋酸是弱電解質的是( )
A.25℃時,測得0.1mol?L-1醋酸鈉溶液的pH約為8 B.25℃時,測得0.1mol?L-1醋酸溶液的pH約為3 C.醋酸稀溶液加入少量醋酸鈉固體,溶液的pH變大 D.醋酸溶液能與碳酸鈉溶液反應 組卷:6引用:2難度:0.7 -
6.相同物質的量濃度的下列化合物的水溶液,按pH減小順序排列的是( )
A.NaHSO4、NH4Cl、NaNO3、CH3COONa B.NaNO3、CH3COONa、NaHSO4、NH4Cl C.CH3COONa、NaNO3、NH4Cl、NaHSO4 D.NaNO3、CH3COONa、NH4Cl、NaHSO4 組卷:12引用:2難度:0.8
三、非選擇題:此題包括4小題,共48分。
-
19.硫代硫酸鈉(Na2S2O3)在工業、醫藥等領域應用廣泛。如圖為實驗室制取硫代硫酸鈉的裝置,反應過程中需通過pH傳感器控制pH為7~8。
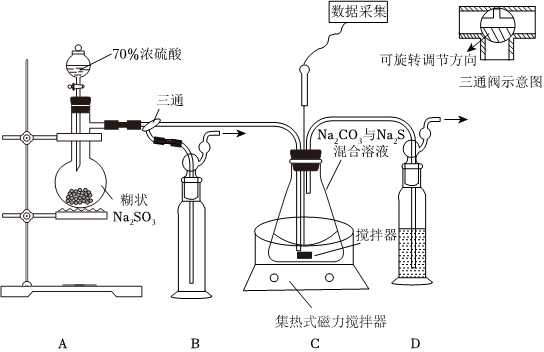
(1)若n(Na2CO3):n(Na2S)=1:2,則裝置C中的化學反應方程式為:。
(2)當數據采集處pH接近7時,應采取的操作為。
(3)裝置B中的藥品可以選擇下列物質中的(填字母)。
A.飽和NaHSO3溶液
B.濃H2SO4
C.酸性KMnO4溶液
D.飽和NaHCO3溶液
(4)乙二醇生產工藝中,向脫碳液中添加V2O5可減少溶液對管道的腐蝕。現使用“碘量法”測定脫碳液中V2O5的含量:取mg脫碳液于錐形瓶中,向錐形瓶中加入適量鹽酸和足量KI溶液,發生反應為V2O5+6HCl+2KI═2VOCl2+2KCl+I2+3H2O,此時溶液顏色為棕色,使用0.1000mol/L的Na2S2O3溶液滴定,消耗Na2S2O3溶液VmL,該過程的反應為I2+2Na2S2O3=2NaI+Na2S4O6(已知有色離子僅有VO2+,其顏色為藍色)。
①滴定終點的現象為:。
②脫碳液中V2O5的質量分數為%
③若滴定時,滴定管未用標準液潤洗,則測得V2O5的含量(填“偏大”、“偏小”、“無影響”,下同);若滴定結束后,俯視讀數,則測得V2O5的含量。組卷:6引用:3難度:0.6 -
20.磁性材料產業是21世紀各國競相發展的高科技支柱產業之一,作為信息產業和機電工業的重要基礎功能材料,磁性材料廣泛用于電子信息、軍事技術等領域。碳酸錳主要用于制備軟磁鐵氧體,工業上以軟錳礦(主要成分為MnO2)和黃鐵礦(主要成分為FeS2)為主要原料制備碳酸錳的主要工藝流程如圖:

已知:幾種金屬離子沉淀的pH如下表。
回答下列問題:Fe2+ Fe3+ Cu2+ Mn2+ 開始沉淀的pH 7.5 3.2 5.2 8.8 完全沉淀的pH 9.2 3.7 7.8 10.4
(1)為了提高溶浸工序中原料的浸出效率,采取的措施不合理的有。
A.攪拌
B.適當升高溫度
C.研磨礦石
D.加入足量的水
(2)溶浸過程中主要產生的金屬陽離子為Fe3+、Mn2+,還含有少量Fe2+、Cu2+、Ca2+。在加入石灰調節溶液的pH前,先加入適量的軟錳礦,其發生反應的離子方程式為,加入石灰調節溶液pH的范圍為。
(3)凈化工序的目的是除去溶液中的Cu2+、Ca2+等雜質,故濾渣主要是CaF2和(填化學式)。若測得濾液中c(F-)為0.001mol?L-1,則凈化工序中Ca2+是否沉淀完全?(填“是”或“否”)[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人認為凈化工序中使用NaF會引起污染,建議用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺點是。
(5)如圖為黃鐵礦的質量分數對錳浸出率的影響,僅據圖中信息,黃鐵礦的質量分數應保持在%左右。 組卷:32引用:3難度:0.6
組卷:32引用:3難度:0.6


