2021-2022學年重慶市高二(上)聯考化學試卷(12月份)
發布:2024/12/9 11:0:2
一、選擇題:本題共14小題,每小題3分,共42分。在每小題給出的四個選項中,只有一項是符合題目要求的。
-
1.煤炭作為我國的基礎能源,在我國一次能源生產和消費結構中,比重一直保持在65%以上;煤炭行業作為我國的上游產業,其價格波動將對我國各相關產業乃至實體經濟構成深遠影響。下列說法正確的是( )
A.煤是無機化合物,天然氣和石油是有機化合物 B.推廣使用“清潔煤”可以減少CO2的排放 C.煤炭發電、植物光合作用都會發生氧化還原反應,并伴隨能量的轉化 D.利用煤燃燒放出的熱量使水分解產生氫氣,是氫能開發的主要研究方向 組卷:4引用:3難度:0.6 -
2.一定條件下,在恒容密閉容器中發生反應3CO2(g)+10H2(g)?C3H8(g)+6H2O(g),達到平衡前的反應速率分別用v(CO2)、v(H2)、v(C3H8)、v(H2O)表示,下列關系式正確的是( )
A. v(C3H8)=v(H2)110B. v(C3H8)=v(H2O)16C. v(CO2)=v(H2)103D. v(H2)=v(H2O)53組卷:27引用:3難度:0.8 -
3.下列說法正確的是( )
A.需要加熱才能發生的反應一定是吸熱反應 B.凡是化合反應都是放熱反應,凡是分解反應都是吸熱反應 C.化學反應一定伴有能量的變化,但有能量變化的過程未必就是化學反應 D.C(石墨,s)═C(金剛石,s)ΔH>0,則金剛石比石墨穩定 組卷:38引用:4難度:0.6 -
4.下列事實不能用電化學理論解釋的是( )
A.鋁片不用特殊方法保存 B.鍍鋅的鐵制品比鍍錫的鐵制品耐用 C.輪船水線以下的船殼上鑲嵌有一定量的鋅塊 D.生鐵比純鐵更易生銹 組卷:0引用:1難度:0.7 -
 5.在一定條件下,對于反應 aM(g)+bN(g)?cP(g)+dR(g)ΔH,M的物質的量分數(M%)與溫度、壓強的關系如圖所示(p1>p2),則下列判斷正確的是( )
5.在一定條件下,對于反應 aM(g)+bN(g)?cP(g)+dR(g)ΔH,M的物質的量分數(M%)與溫度、壓強的關系如圖所示(p1>p2),則下列判斷正確的是( )A.ΔH>0,ΔS>0 B.ΔH<0,ΔS>0 C.ΔH<0,ΔS<0 D.ΔH>0,ΔS<0 組卷:8引用:3難度:0.7 -
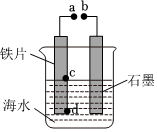 6.模擬電化學腐蝕及防護的裝置如圖所示,下列有關說法正確的是( )
6.模擬電化學腐蝕及防護的裝置如圖所示,下列有關說法正確的是( )A.若a、b用導線連接,則鐵片主要發生析氫腐蝕 B.若a、b不用導線連接,則d處比c處更易產生鐵銹 C.若a、b分別連接電源的正、負極,則會加快鐵片的腐蝕 D.若a、b用導線連接,將石墨換成銅棒,則鐵片的腐蝕會減慢 組卷:56引用:3難度:0.6
二、非選擇題:本題共4小題,共58分。
-
17.氮的氧化物排放至大氣中會造成大氣污染,但四氧化二氮可在火箭發射中作氧化劑。
(1)已知:①N2(g)+2O2(g)═N2O4(g)ΔH=+10.7kJ?mol-1
②N2H4(g)+O2(g)═N2(g)+2H2O(g)ΔH=-543kJ?mol-1
則N2O4(g)和N2H4(g)反應生成N2(g)和H2O(g)的熱化學方程式為。
(2)N2O4與NO2可相互轉化:N2O4(g)?2NO2(g)ΔH=+56.9kJ?mol-1在恒溫條件下,將一定量NO2(g)和N2O4(g)的混合氣體充入體積為2L的恒容密閉容器中,其物質的量濃度隨時間變化的關系如圖所示。
①前10min內,該反應的平均反應速率v(NO2)=。
②a、b、c、d四點中v(正)=v(逆)的點有(填字母)。
③該溫度下,該反應的化學平衡常數K=mol?L-1。
④25min時,改變的具體條件為,d點對應物質的物質的量濃度(填“大于”、“小于”或“等于”)0.8mol?L-1,理由是。組卷:1引用:1難度:0.5 -
18.硫酸鉛(PbSO4)廣泛用于制造鉛蓄電池、白色顏料等。工業生產中利用方鉛礦(主要成分為PbS,含有FeS2等雜質)和軟錳礦(主要成分為MnO2)制備PbSO4的工藝流程如圖:

已知:ⅰ.PbCl2難溶于冷水,易溶于熱水;
ⅱ.PbCl2(s)+2Cl-(aq)?(aq)ΔH>0;PbCl2-4
ⅲ.KsP[Fe(OH)3]=2.8×10-39,Ksp(PbSO4)=2.5×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”時,工業上選擇的溫度為80℃,選擇此溫度的優點有。(只答一條)
(2)“浸取”過程中鹽酸、NaCl與MnO2、PbS發生反應生成Na2PbCl4、MnCl2和MnSO4的化學方程式為;為探究“浸取”的條件,實驗室用PbS,MnO2、鹽酸、NaCl在一定條件下模擬反應,模擬過程中發現有淡黃色沉淀產生,產生該沉淀的離子方程式為。
(3)該工藝流程圖中用到了次過濾操作,實驗室中進行過濾操作需注意“一貼、二低、三靠”,“二低”指的是。
(4)常溫時,為使溶液中Fe3+沉淀完全(當溶液離子濃度小于等于10-5mol?L-1時,沉淀就達完全),加NaOH調pH的最小值為(填整數);“廢液”中大量含有的陰離子包括(填離子符號)。
(5)“濾液a”經過處理后可以返回到工序循環使用;當“濾液a”中時,c()=SO2-4mol?L-1。組卷:4引用:1難度:0.7


