2021-2022學年浙江省金華市十校高二(上)期末化學試卷
發布:2024/11/12 8:0:39
一、選擇題(本大題共20小題,1-10題每小題2分,11-20題每小題2分,共50分.每小題列出的四個備選項中只有一個符合題目要求,不選、多選、錯選均不得分)
-
1.下列粒子對水的電離沒有影響的是( )
A.CH3COOH B. 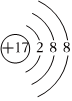
C.M-:1s22s22p6 D. 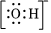 組卷:19引用:3難度:0.8
組卷:19引用:3難度:0.8 -
2.下列可逆反應達到平衡后,減壓時平衡逆向移動的是( )
A.2NH3(g)?N2(g)+3H2(g) B.2NO(g)?N2(g)+O2(g) C.3O2(g)?2O3(g) D.CO32-(aq)+H+(aq)?HCO3-(aq) 組卷:14引用:2難度:0.5 -
3.下列敘述錯誤的是( )
A.鐵制品上鍍銅:鐵制品為陽極,銅鹽為電鍍液 B.電解飽和食鹽水,Cl-比OH-更易在陽極失去電子 C.放電時,鉛酸蓄電池中硫酸濃度不斷變小 D.外加電流法保護鋼鐵設備時,選用惰性輔助陽極 組卷:8引用:1難度:0.7 -
4.下列敘述正確的是( )
A.可能存在電子排布式為1s22s22p63s23p64s24p1的基態原子 B.基態原子的電子排布在同能級的簡并軌道時,優先分占不同軌道 C.同一周期的兩種元素,電負性大者,第一電離能也大 D.I1(Na)=496kJ/mol,即1mol鈉原子失去3s1電子時吸收496kJ能量 組卷:15引用:1難度:0.6 -
5.下列事實與給出化學式的鹽的水解有關的是( )
A.濃FeCl3溶液可觀察到丁達爾效應 B.用CaSO4改良土壤的鹽堿化 C.用添加NaF的牙膏預防齲齒 D.NaHSO4溶液呈酸性 組卷:38引用:2難度:0.8 -
6.已知NA是阿伏加德羅常數的值,下列說法不正確的是( )
A.0.31g基態P原子中,含p能級電子的數目為0.09NA B.1min內NaOH吸收0.1NA個Cl2,則Cl2的反應速率為0.1mol?L-1?min-1 C.室溫下,100mLpH=3的檸檬水中H+的數目為10-4NA D.氫氧燃燒電池中每消耗4.48LH2(標準狀況下),則外電路通過電子0.4NA 組卷:8引用:1難度:0.5 -
7.常溫下,下列關于醋酸及醋酸鹽的說法錯誤的是( )
A.純水中逐滴加入冰醋酸后,Kw減小 B.CH3COONa溶液呈堿性,說明CH3COOH是弱酸 C.鐵與稀硫酸反應時,加少量醋酸鈉固體,H2的生成速率減小 D.將CH3COONa溶液小火蒸干,可獲得CH3COONa晶體 組卷:3引用:1難度:0.7 -
8.室溫下,將0.20mol?L-1HCN溶液和0.10mol?L-1Ba(OH)2溶液等體積混合后,溶液顯弱堿性。下列關系正確的是( )
A.c(HCN)>c(CN-) B.c(Ba2+)<c(CN-) C.2c(HCN)+2c(CN-)=c(Ba2+) D.c(HCN)+c(CN-)=0.20mol?L-1 組卷:6引用:2難度:0.6
二、非選擇題(共4小題,共50分)
-
 23.氯化銨(NH4Cl)是一種重要的化工產品.請回答:
23.氯化銨(NH4Cl)是一種重要的化工產品.請回答:
Ⅰ.室溫下,0.1mol?L-1的NH4Cl溶液pH=5.NH4Cl溶液呈酸性的原因是(用離子方程式表示),10-5-10-9=(用微粒符號式表示).
Ⅱ.NH4Cl作氮肥會導致土壤酸化及Cl-含量超標,前景越來越差.化工專家提出用MgO將NH4Cl轉化為附加值更高的NH3和HCl.
(1)有研究認為轉化過程分兩步完成,原理如下:
水化:MgO(s)+H2O(l)=Mg(OH)2(s)
蒸氨:Mg(OH)2(s)+2(aq)?Mg2+ (aq)+2NH3?H2O(aq)NH+4
已知Kb(NH3?H2O)=2×10-5,Ksp[Mg(OH)2]=5×10-12.“裝氨”反應的平衡常數K=.加熱有利于提高蒸氨率,原因是.
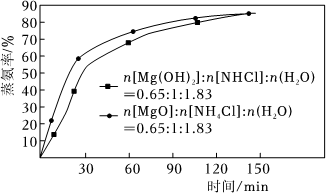
(2)最新研究發現,MgO比Mg(OH)2更有利于蒸氨,結果如圖所示:
①“蒸氨率”測定:加熱混合物,蒸出的NH3用過量H2SO4吸收,稀釋吸收液并定容至250mL,取出25mL用NaOH標準溶液滴定至終點.滴定前的下列操作的正確順序是(填字母).
a.盛裝NaOH標準溶液
b.用NaOH標準溶液潤洗
c.讀數、記錄
d.查漏、清洗
e.排盡滴定管尖嘴的氣泡并調整液面
②下列操作會造成所測“蒸氨率”偏大的是(填字母).
a.滴定終點時俯視讀數
b.錐形瓶用稀釋后的吸收液潤洗
c.滴定前有氣泡,滴定后沒有氣泡
d.定容250mL吸收液時,有少量溶液濺出
③研究者認為:前30min,由于MgO表面存在:MgO(s)+H2O(l)→Mg(OH)+(s)+OH-(aq),比Mg(OH)2固體產生了更多的OH-,提高了“蒸氨率”.請設計實驗證明:.
(3)煅燒副產物MgCl2?6H2O實現MgO再生,其反應方程式為.組卷:3引用:1難度:0.6 -
24.K2Cr2O7是實驗室中重要的試劑.請回答:
(1)基態Cr原子的核外電子排布式為.
(2)(黃色)和Cr2CrO2-4(橙色)在溶液中可相互轉化.O2-7
①用離子方程式表示Na2CrO4溶液加酸的轉化反應.
②隨著溶液pH降低,的平衡轉化率CrO2-4(填“增大”“減小”或“不變”).
③加水稀釋Na2CrO4溶液,下列說法正確的是(選填序號).
A.c()+2c(Cr2CrO2-4)=c(Na+)O2-7
B.比值逐漸增大c(CrO42-)c(Cr2O72-)
C.溶液中所有離子的濃度均減小
D.平衡常數K保持不變
(3)Cr3+、雙氧水與Pb2+作用可合成顏料鉻黃(PbCrO4).控制其他條件不變,反應溫度對Cr3+轉化率的影響如圖1所示.溫度超過70℃時,Cr3+轉化率下降的原因是.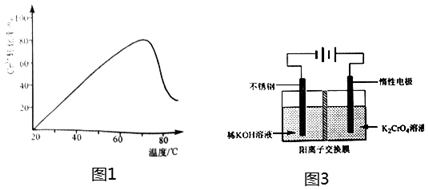
(4)控制Na2CrO4初始濃度為1.0mol?L-1,測定在室溫下c(Cr2)隨c(H+)的等溫變化曲線、在H+恒定下c(Cr2O2-7)隨溫度T的等pH變化曲線,結果如圖2所示.O2-7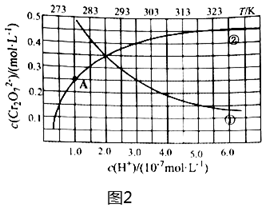
①等溫變化曲線是(填曲線序號).
②結合題給信息,(填“升溫”或“降溫”)可使溶液橙色變深.
③根據A點數據,計算反應的平衡常數.
(5)電解鉻酸鉀溶液制備重鉻酸鉀的裝置示意圖如圖3:
①該制備過程總反應的化學方程式為.
②電解一段時間后,陽極區溶液中的K+的物質的量由amol變成bmol,則生成的重鉻酸鉀的物質的量為mol.組卷:6引用:1難度:0.6


