2022-2023學(xué)年上海交大附中高二(上)期中化學(xué)試卷
發(fā)布:2024/4/20 14:35:0
一、選擇題(每小題只有1個(gè)正確答案)
-
1.下列不屬于自發(fā)進(jìn)行的變化是( )
A.紅墨水加到清水使整杯水變紅 B.冰在室溫下融化成水 C.電解飽和食鹽水 D.鐵器在潮濕的空氣中生銹 組卷:64引用:8難度:0.9 -
 2.逆流能使物質(zhì)充分接觸,硫酸工業(yè)中未采取逆流工藝的是( )
2.逆流能使物質(zhì)充分接觸,硫酸工業(yè)中未采取逆流工藝的是( )A.O2和V2O5 B.硫鐵礦和空氣 C.濃硫酸和SO3 D.SO2、O2和平衡混合氣 組卷:44引用:1難度:0.8 -
3.接觸室中采取常壓條件,是因?yàn)椋ā 。?/h2>
A.反應(yīng)速率快 B.促進(jìn)平衡右移 C.SO2轉(zhuǎn)化率已經(jīng)很大 D.催化劑活性最佳 組卷:17引用:1難度:0.5 -
4.下列電化學(xué)裝置中的物質(zhì)的濃度不變的是( )
A.電鍍池中的電鍍液 B.粗銅精煉中的電解液 C.雙液原電池鹽橋中的電解質(zhì) D.鉛酸蓄電池中的硫酸 組卷:29引用:2難度:0.7 -
5.對(duì)鋼鐵析氫腐蝕和吸氧腐蝕的比較,合理的是( )
A.負(fù)極反應(yīng)不同 B.正極反應(yīng)相同 C.析氫腐蝕更普遍 D.都是電化學(xué)腐蝕 組卷:99引用:3難度:0.7 -
6.異辛烷是優(yōu)良的發(fā)動(dòng)機(jī)燃料,其結(jié)構(gòu)為:
 ,下列說法正確的是( )
,下列說法正確的是( )A.異辛烷系統(tǒng)命名為:2,4,4-三甲基戊烷 B.異辛烷沸點(diǎn)低于正辛烷 C.異辛烷一氯代物種類為5種 D.異辛烷可溶于水和酒精 組卷:544引用:2難度:0.7 -
7.短周期元素A、B可形成原子個(gè)數(shù)比為1:3的化合物,則兩者原子序數(shù)之差可能是( )
①2
②4
③5
④6
⑤8A.②④⑤ B.②③④ C.①②④⑤ D.①②③④⑤ 組卷:32引用:1難度:0.7 -
8.完全燃燒相同質(zhì)量的烷烴,消耗氧氣的隨著C原子數(shù)的增加而( )
A.減小 B.不變 C.增加 D.星周期性變化 組卷:228引用:3難度:0.6
二、綜合分析題
-
23.I2O5是一種無機(jī)化合物,主要用作氧化劑,可除去空氣中的一氧化碳。
已知自發(fā)反應(yīng):2I2(s)+5O2(g)═2I2O5(s)ΔH1Ⅰ
I2O5(s)+5CO(g)?5CO2(g)+I2(s)ΔH2=-1377.2kJ/molⅡ
(1)結(jié)合反應(yīng)Ⅰ和反應(yīng)Ⅱ分析,I2在CO轉(zhuǎn)化為CO2的反應(yīng)中所起的作用是,判斷ΔH10(填“<”或“>”)。
(2)若在恒溫恒容的密閉體系中進(jìn)行上述反應(yīng)Ⅱ,下列能說明反應(yīng)Ⅱ達(dá)到平衡狀態(tài)的是(填序號(hào))。
a.平衡常數(shù)K保持不變
b.CO和CO2的物質(zhì)的量相等
c.v(CO)=v(CO2)
d.混合氣體的平均分子量不變
(3)10℃時(shí),某恒容密閉容器中充有足量的I2O5,向該容器中充入CO,發(fā)生反應(yīng)Ⅱ,平衡時(shí)CO2與充入CO的物質(zhì)的量關(guān)系如圖所示。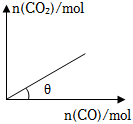
若只降低溫度,θ值(填“增大”“減小”或“不變”,下同);若只充入CO2,θ值。
(4)20℃時(shí)向裝有足量I2O5的2L恒容密閉容器中充入2molCO,發(fā)生反應(yīng)Ⅱ,經(jīng)5s反應(yīng)達(dá)到平衡后固體質(zhì)量減小8g。
①0~5秒內(nèi)v(CO2)=mol/(L?s)。
②如圖是CO的平衡轉(zhuǎn)化率隨CO2的移出率關(guān)系圖[CO2的移出率=]關(guān)系,則圖中a=n(CO2實(shí)際移出量)n(理論生成量)×100%。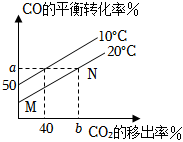 組卷:23引用:1難度:0.5
組卷:23引用:1難度:0.5 -
24.合成氨是人工固氮的主要手段,對(duì)人類生存社會(huì)進(jìn)步和經(jīng)濟(jì)發(fā)展都有著重大意義。該反應(yīng)歷程和能量變化如圖所示,其中吸附在催化劑表面上的物種用“吸”標(biāo)注。
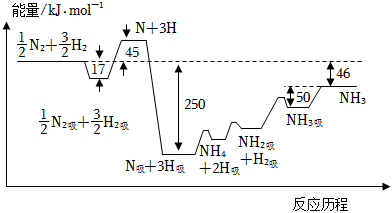
(1)合成氨反應(yīng)的平衡常數(shù)表達(dá)式為。
(2)下表為不同溫度下合成氨反應(yīng)的平衡常數(shù)。由此可推知,表中T2572(填“>”“<”或“=”)。
(3)寫出合成氨反應(yīng)的熱化學(xué)方程式T/K T1 572 T2 K 1.00×107 2.45×105 1.88×103 。
(4)根據(jù)反應(yīng)歷程和能量變化圖,計(jì)算反應(yīng)N2+3H2?2NH3決速步驟的活化能kJ/mol。
(5)在定溫度下,將3molH2和1molN2置于2L密閉容器中,反應(yīng)達(dá)到平衡時(shí),混合氣體中NH3的體積分?jǐn)?shù)為,該反應(yīng)的平衡常數(shù)K=37。(用分?jǐn)?shù)表示)
(6)利用反應(yīng)6NO2+8NH3═7N2+12H2O構(gòu)成電池,能實(shí)現(xiàn)有效消除氮氧化物的排放,減輕環(huán)境污染,裝置如圖所示: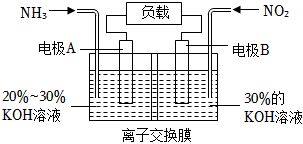
①寫出電極B的電極反應(yīng)式:。
②當(dāng)溶液中有0.4molOH-經(jīng)過交換膜時(shí),通過外電路的電子數(shù)為。組卷:27引用:1難度:0.7


